题目内容
正确表示下列反应的离子方程式的是( )
| A、氢氧化钠溶液与盐酸反应:H++OH-=H2O |
| B、铁溶于氯化铁溶液:Fe3++Fe=2Fe2+ |
| C、碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O |
| D、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
考点:离子方程式的书写
专题:
分析:A.氢氧化钠与盐酸酸碱中和生成水;
B.电荷不守恒;
C.碳酸钙难溶于水保留化学式;
D.电荷不守恒.
B.电荷不守恒;
C.碳酸钙难溶于水保留化学式;
D.电荷不守恒.
解答:
解:A.氢氧化钠溶液与盐酸反应离子方程式:H++OH-=H2O,故A正确;
B.铁溶于氯化铁溶液离子反应方程式:2Fe3++Fe=3Fe2+,故B错误;
C.碳酸钙与盐酸反应离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,故C错误;
D.钠与水反应离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故D错误;
故选A.
B.铁溶于氯化铁溶液离子反应方程式:2Fe3++Fe=3Fe2+,故B错误;
C.碳酸钙与盐酸反应离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,故C错误;
D.钠与水反应离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故D错误;
故选A.
点评:本题考查了离子方程式书写正误的判断,题目简单,把握反应的实质是解题的关键,注意电荷守恒、原子个数守恒的应用.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
向含有下列离子的水溶液中,加入一小块金属钠,引起离子数目减少的是( )
| A、CO32- |
| B、OH- |
| C、HCO3- |
| D、Cu2+ |
在Na2S水溶液中c(Na+)与c(S2-)的关系是( )
| A、c(Na+)=2c(S2-) |
| B、c(Na+)<2c(S2-) |
| C、c(Na+)>2c(S2-) |
| D、2c(Na+)=c(S2-) |
制作汽车内胎的材料是( )
| A、纤维素 | B、聚四氟乙烯 |
| C、玻璃钢 | D、丁基橡胶 |
已知可逆反应A(g)+3B(g)═2C(g),△H=-Q kJ/mol(Q>0).有甲、乙两个体积保持不变的密闭容器,向甲容器中加入1mol A和3mol B,在一定条件下达到平衡时放出热量为Q1 kJ.在相同条件下,向乙中加入2mol C达到平衡后吸收热量Q2 kJ,已知Q1=3Q2.下列叙述正确的是( )
| A、甲中反应达到平衡时Q1=Q |
| B、达到平衡时,甲中C的体积分数比乙大 |
| C、达到平衡后,再向乙中加入0.25mol A、0.75mol B和0.5mol C,反应向生成C的方向进行 |
| D、乙中发生的反应热化学方程式为2C(g)?A(g)+3B(g)△H=+Q2 kJ/mol |
下列关于平衡常数(K)的说法中正确的是( )
| A、相同温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同 | ||
| B、相同温度下,水的离子积常数就是水的电离平衡常数 | ||
C、由K水解=
| ||
| D、同温同浓度条件下,一元弱酸的电离平衡常数(K)越小,则溶液的pH越小 |
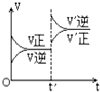 对达到平衡状态的可逆反应:X(?)+Y(?)?W(?)+Z(?)(已配平),在t'时增大压强,则正逆反应速率变化如右图所示(V代表速率,t代表时间.下列有关X、Y、Z、W的状态叙述正确的是( )
对达到平衡状态的可逆反应:X(?)+Y(?)?W(?)+Z(?)(已配平),在t'时增大压强,则正逆反应速率变化如右图所示(V代表速率,t代表时间.下列有关X、Y、Z、W的状态叙述正确的是( )| A、X、Y、W为气体,Z不是气体 |
| B、X、Y为气体,W、Z中有一种是气体 |
| C、W、Z为气体,X、Y中有一种是气体 |
| D、W、Z中有一种为气体,X、Y都不是气体 |
