题目内容
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应Al2O3+3C+N2=2AlN+3CO合成.下列分析中正确的是( )
| A、上述反应中,CO是还原产物 |
| B、AlN中氮元素的化合价为+3 |
| C、上述反应中,每生成1molAlN转移的电子数为3NA |
| D、AlN的摩尔质量为41 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:反应Al2O3+3C+N2=2AlN+3CO中,C元素化合价升高,N元素化合价降低,反应中N2为氧化剂,C为还原剂,结合化合价的变化分析判断电子转移的数目,以此解答该题.
解答:
解:A.反应中C元素化合价升高,被氧化,则CO为氧化产物,故A错误;
B.AlN中N为-3价,Al元素化合价为+3价,故B错误;
C.每生成1molAlN,N元素化合价由0价降低到-3价,则转移的电子数为3NA,故C正确;
D.AlN的摩尔质量为41g/mol,故D错误.
故选C.
B.AlN中N为-3价,Al元素化合价为+3价,故B错误;
C.每生成1molAlN,N元素化合价由0价降低到-3价,则转移的电子数为3NA,故C正确;
D.AlN的摩尔质量为41g/mol,故D错误.
故选C.
点评:本题考查氧化还原反应,为高考常见题型,难度不大,注意从元素化合价的角度认识氧化还原反应的概念和物质的性质.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
 新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni,在该盐中均显+2价)由铁酸盐(MFe2O4)经高温与氢气反应制得,常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图.关于此转化过程的叙述不正确的是( )
新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni,在该盐中均显+2价)由铁酸盐(MFe2O4)经高温与氢气反应制得,常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图.关于此转化过程的叙述不正确的是( )| A、MFe2O4在与H2的反应中表现了氧化性 |
| B、MFe2O4与MFe2Ox的相互转化反应均属于氧化还原反应 |
| C、MFe2Ox与SO2反应中MFe2Ox被还原 |
| D、若4 mol MFe2Ox与1 mol SO2恰好完全反应,则MFe2Ox中x的值为3.5 |
下列说法正确的是(NA表示阿伏加德罗常数)( )
| A、在常温常压下,11.2 L N2含有的分子数为0.5 NA |
| B、在常温常压下,1mol He含有的原子数为2 NA |
| C、71g Cl2 所含原子数为2 NA |
| D、23g Na在化学反应中失去的电子数目为10 NA |
下列实验方案中,能测定Na2CO3和NaHCO3混合物中NaHCO3质量分数的是( )
①取a克混合物充分加热,减重b克
②取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
③取a克混合物与足量稀酸充分反应,逸出气体先用浓硫酸干燥再用碱石灰吸收,碱石灰增重b克
④取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
①取a克混合物充分加热,减重b克
②取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
③取a克混合物与足量稀酸充分反应,逸出气体先用浓硫酸干燥再用碱石灰吸收,碱石灰增重b克
④取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
| A、只有①②④ | B、①②③④ |
| C、只有①③④ | D、只有①②③ |
从植物花中可提取一种简写为HIn的有机物,它在水溶液中因存在下列平衡:HIn(溶液,红色)?H+(溶液)+In-(溶液,黄色) 而用作酸碱指示剂.往该溶液中加入Na2O2粉末,则溶液颜色为( )
| A、黄色变浅 | B、红色变深 |
| C、褪为无色 | D、黄色变深 |
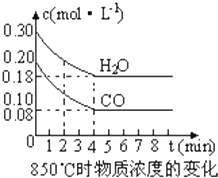 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示



