题目内容
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)═CO2(g)+H2(g)△H<0
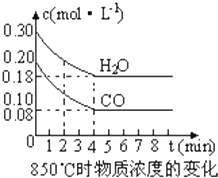
CO和H2O浓度变化如图所示,则0~4min的平均反应速率v(CO)=
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中3min~4min之间反应处于
②反应在4min~5min间,平衡向逆方向移动,可能的原因是
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
考点:物质的量或浓度随时间的变化曲线,化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:(1)依据平衡常数是表示平衡进行程度大小的量;化学反应吸热或放热反应,温度升高平衡向吸热反应方向进行;
(2)0-4min可知,△c=0.2mol/L-0.08mol/L=0.12mol/L,结合v(CO)=
计算; 在4~5min时达到平衡状态,H2浓度变化为零,平均反应速率为零;
(3)①表中3min-4min之间各物质的浓度不变,达到平衡状态,该反应为放热反应,升高温度逆向移动,c(CO)>0.08mol/L;
②根据4min-5min之间、5min-6min之间,各物质的浓度变化判断改变的条件.
(2)0-4min可知,△c=0.2mol/L-0.08mol/L=0.12mol/L,结合v(CO)=
| △c |
| △t |
(3)①表中3min-4min之间各物质的浓度不变,达到平衡状态,该反应为放热反应,升高温度逆向移动,c(CO)>0.08mol/L;
②根据4min-5min之间、5min-6min之间,各物质的浓度变化判断改变的条件.
解答:
解:(1)化学平衡常数K表示可逆反应的进行程度,依据平衡常数含义可知,K值越大,可逆反应的进行程度越大;温度升高,平衡向吸热反应方向进行,反应可能是吸热反应,也可能是放热反应,所以温度升高,平衡常数可能增大也可能减小,
故答案为:可逆反应的进行程度越大;可能增大也可能减小;
(2)0-4min可知,△c=0.2mol/L-0.08mol/L=0.12mol/L,则v(CO)=
=
=0.03mol?(L?min)-1,在4~5min时达到平衡状态,H2浓度变化为零,平均反应速率为零;
故答案为:0.03;0;
(3)①表中3min-4min之间各物质的浓度不变,达到平衡状态,该反应为放热反应,升高温度逆向移动,c(CO)>0.08mol/L,
故答案为:平衡;大于;
②C1>0.08mol/L,则C3<0.12mol/L,C2>0.18mol/L,4min-5min之间,平衡向逆方向移动,二氧化碳的浓度降低,一氧化碳和水蒸气的浓度都增大,所以改变的条件是增大氢气的浓度;
5min-6min之间,一氧化碳浓度减小,水蒸气和二氧化碳浓度增大,平衡向正反应方向移动,则改变的条件是增大水蒸气的浓度;
故答案为:d;a.
故答案为:可逆反应的进行程度越大;可能增大也可能减小;
(2)0-4min可知,△c=0.2mol/L-0.08mol/L=0.12mol/L,则v(CO)=
| △c |
| △t |
| 0.12mol/L |
| 4min |
故答案为:0.03;0;
(3)①表中3min-4min之间各物质的浓度不变,达到平衡状态,该反应为放热反应,升高温度逆向移动,c(CO)>0.08mol/L,
故答案为:平衡;大于;
②C1>0.08mol/L,则C3<0.12mol/L,C2>0.18mol/L,4min-5min之间,平衡向逆方向移动,二氧化碳的浓度降低,一氧化碳和水蒸气的浓度都增大,所以改变的条件是增大氢气的浓度;
5min-6min之间,一氧化碳浓度减小,水蒸气和二氧化碳浓度增大,平衡向正反应方向移动,则改变的条件是增大水蒸气的浓度;
故答案为:d;a.
点评:本题考查化学反应速率及化学平衡,明确表格中数据分析及图象的分析是解答本题的关键,注重学生能力的考查,题目难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
关于O2和SO2两种气体的叙述,正确的是( )
| A、两者质量相等时,其分子数相等 |
| B、两者质量相等时,其原子数相等 |
| C、同温同压时,两者密度之比为1:2 |
| D、同温同压时,同体积气体所含原子数相等 |
若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能大量共存的是( )
| A、NH4+、NO3-、CO32-、Na+ |
| B、Na+、Ba2+、HCO3-、AlO2- |
| C、NO3-、Fe2+、K+、Cl- |
| D、NO3-、K+、AlO2-、OH- |
阿伏加德罗常数为NA,标况下如果m g某物质中含有的分子数为b,则该物质的摩尔质量可表示为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
某K2SO4、Na2SO4混合溶液V mL中,测得c(K+)=0.3mol/L,c(Na+)=0.1mol/L.从中取
mL溶液稀释至2V mL.稀释后溶液中c(SO42-)为( )
| V |
| 2 |
| A、0.0125 mol/L |
| B、0.025 mol/L |
| C、0.05 mol/L |
| D、0.1 mol/L |
Cl2是一种十分活泼的非金属单质,除了具有极强的氧化性外,还可以在一定条件下与NaOH等碱溶液反应,如3Cl2+6NaOH(浓)
5NaCl+NaClO3+3H2O.在该反应中,氯元素发生的变化是( )
| ||
| A、只是被氧化 |
| B、只是被还原 |
| C、有的被氧化,有的被还原 |
| D、既未被氧化,也未被还原 |
下列离子方程式正确的是( )
| A、铝与氢氧化钠溶液反应:2Al+2OH-+H2O═2[Al(OH)4]-+H2↑ | ||
B、过氧化钠与水反应:2O
| ||
C、把少量碳酸氢钠溶液加入到氢氧化钡溶液中:HCO
| ||
D、金属铜跟浓硝酸反应:3Cu+2NO
|
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应Al2O3+3C+N2=2AlN+3CO合成.下列分析中正确的是( )
| A、上述反应中,CO是还原产物 |
| B、AlN中氮元素的化合价为+3 |
| C、上述反应中,每生成1molAlN转移的电子数为3NA |
| D、AlN的摩尔质量为41 |