题目内容
9.向150mL1mol•L-1的盐酸中加入9.5gNa2CO3和NaHCO3混合粉末.恰好完全反应.试计算:(1)混合粉末Na2CO3和NaHCO3中的质量分别为多少克?
(2)反应理论上生成气体的体积为多少升(标准状况下)?
(3)假设反应前后溶液体积不变.所得溶液中Na的物质的量浓度为多少?
分析 向150mL1mol•L-1的盐酸中加入9.5gNa2CO3和NaHCO3混合粉末.恰好完全反应,生成单一的氯化钠,根据钠守恒和质量守恒列方程组进行求解,由此分析解答.
解答 解:9.5gNa2CO3和NaHCO3混合粉末中Na2CO3和NaHCO3的物质的量分别为xmol和ymol,则$\left\{\begin{array}{l}{2x+y=0.15×1}\\{106x+84y=9.5}\end{array}\right.$,解之得:$\left\{\begin{array}{l}{x=0.05mol}\\{y=0.05mol}\end{array}\right.$
(1)混合粉末Na2CO3和NaHCO3中的质量分别为0.05×106=5.3g和0.05×84=4.2g,答:Na2CO3和NaHCO3中的质量分别为5.3g和4.2g;
(2)根据碳守恒,反应理论上生成气体的体积为:(0.05+0.05)×22.4=2.24L,答:反应理论上生成气体的体积为2.24L;
(3)Na+的物质的量浓度为:$\frac{0.05×2+0.05}{0.15}$=1mol/L,答:所得溶液中Na+的物质的量浓度为1mol/L.
点评 本题考查钠的化合物与酸的反应,明确发生的化学反应和产物,利用守恒法即可快速解答.

练习册系列答案
相关题目
20.用含有少量SiO2(酸性氧化物)的铝片制取纯净的氢氧化铝,有下列操作步骤,最恰当的组合是(按先后顺序排列)( )
①加盐酸溶解
②加过量烧碱溶液溶解
③过滤
④通入过量CO2生成Al(0H)3沉淀
⑤加入盐酸,生成Al(0H)3沉淀
⑥加入过量氨水溶液,生成Al(0H)3沉淀.
①加盐酸溶解
②加过量烧碱溶液溶解
③过滤
④通入过量CO2生成Al(0H)3沉淀
⑤加入盐酸,生成Al(0H)3沉淀
⑥加入过量氨水溶液,生成Al(0H)3沉淀.
| A. | ①③⑥③ | B. | ②③⑥③ | C. | ②③④③ | D. | ②③⑤③ |
17.某烃的一种同分异构体只能生成一氯代物,该烃的分子式不可以是( )
| A. | C3H6 | B. | C5H12 | C. | C6H14 | D. | C8H18 |
4.下列说法正确的是( )
| A. | 已知P(红磷,s)=P(白磷,s)△H>0,则白磷比红磷稳定 | |
| B. | 测定相同物质的量浓度的Na2CO3、Na2SiO3的溶液pH,发现后者的更高,说明碳的非金属性强于硅 | |
| C. | 温度和压强一定时,对于可逆反应:2NO2(g)?N2O4(g),混合气体的密度不再改变,则反应达到平衡状态. | |
| D. | 将NaAlO2溶液与NaHCO3溶液混合后生成白色沉淀,是两种溶液水解相互促进的结果 |
14.一定条件下,将aL SO3气体通过装有V2O5的硬质试管后,气体体积变为bL(气体体积均在同温同压下测定),该bL气体中SO3的体积分数是( )
| A. | $\frac{b-a}{b}$ | B. | $\frac{2(b-a)}{b}$ | C. | $\frac{3a-2b}{b}$ | D. | $\frac{2b-3a}{b}$ |
4.下列有关化学用语表示正确的是( )
| A. | CO2分子的比例模型: | |
| B. | 过氧化氢的电子式: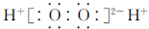 | |
| C. | 氟原子的结构示意图: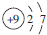 | |
| D. | H2CO3的电离方程式:H2CO3?2H++CO32- |