题目内容
16.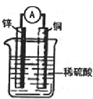 如图为某原电池示意图,请回答下列问题,
如图为某原电池示意图,请回答下列问题,(1)该装置将化学能转化为电能.
(2)该电池的正极为铜,该电极上的现象是浸没在稀硫酸中的铜片表面有气泡产生,电极反应式为2H++2e-=H2↑.
(3)该电池工作一段时间后,烧杯中溶液的总质量增大(填“增大”、“减小”或“不变”),若此过程中共转移0.2mol电子,则锌片的质量减轻6.5g.
分析 在原电池中较活泼的金属作负极,失电子发生氧化反应,电子经导线传递到正极,溶液中阳离子移向正极,阴离子移向负极.Zn比Cu活泼,Zn做负极电极反应式为:Zn-2e-=Zn2+,Cu作正极,电极反应为:2H++2e-=H2↑,发生电池反应:Zn+2H+=Zn2++H2↑.
解答 解:(1)铜锌原电池是将化学能转化为电能的装置,故答案为:化学;电;
(2)铜锌原电池中铜是电池的正极,锌是负极,正极上是氢离子得电子的还原反应,即2H++2e-=H2↑,会看到在铜片上产生气泡,故答案为:铜;浸没在稀硫酸中的铜片表面有气泡产生;2H++2e-=H2↑;
(3)根据装置中发生的电池反应:Zn+2H+=Zn2++H2↑,电池工作一段时间后,烧杯中溶液的总质量增大,若此过程中共转移0.2mol电子,根据负极反应:Zn-2e-=Zn2+,则锌片的质量减轻0.1mol即6.5g,故答案为:6.5.
点评 本题考查原电池的工作原理,明确发生的原电池反应是解答本题的关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.已知锶的核电核数为38,其单质密度为2.50g/cm3,下列说法中一定错误的是( )
| A. | 颗粒状的单质锶与稀硫酸反应,反应现象不如钠和水反应剧烈 | |
| B. | 锶在纯净氮气中可以燃烧,燃烧产物投入水中可以放出气体 | |
| C. | 锶在纯氧中点燃可燃烧,燃烧生产的产物投入水中可以放出气体 | |
| D. | 颗粒状的单质锶投入水中,剧烈反应,生成大量的气体并引起气体燃烧和轻微爆炸 |
4.在一定条件下,1mol白磷转化为红磷放出29.2KJ热能.在该条件下,下列说法正确的是( )
| A. | 白磷比红磷的能量低 | |
| B. | 白磷比红磷稳定 | |
| C. | 该变化为物理变化 | |
| D. | 该变化的本质是旧化学键断裂,新化学键形成 |
11.C+O2?2CO是一个可逆反应,下列关于该反应的说法中,正确的是( )
| A. | 该反应进行到一定程度时即停止 | |
| B. | 反应开始之初,正反应速率大于逆反应速率 | |
| C. | 若在密闭容器中反应,C和CO2能100%转化为CO | |
| D. | 使用碳粉和碳块,对该反应的速率无明显影响 |
1.合成氨是人类科学技术上的一项重大突破,曾三次获诺贝尔化学奖,下列说法错误的是( )
| A. | 合成氨技术实现了“从空气到面包” | |
| B. | 合成氨涉及氧化还原反应 | |
| C. | 高效催化剂是合成氨反应的重要条件 | |
| D. | 合成氨所需要的氢气主要来自于电解水 |
8.纪录片《舌尖上的中国》展示了中化饮食文化的博大精深.下列烹饪用品的调味成分属于无机物的是( )
| A. | 香醋 | B. | 食盐 | C. | 麻油 | D. | 黄酒 |
5.若在加入铝粉能放出氢气的溶液中,下列各组离子可能共存的是( )
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、Mg2+、HCO3- | ||
| C. | NO3-、K+、[Al(OH)4]-、OH- | D. | NO3-、Mg2+、K+、Cl- |
6.下表是元素周期表的一部分,已知⑥为短周期元素,其单质为淡黄色固体,据表回答有关问题:
(1)⑥的元素符号S,画出其原子结构示意图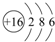
(2)元素①③⑧最外层电子数都为1,在周期表中在同一列,称为碱金属元素,③的金属性<⑧的金属性(填>、=、<).
(3)②⑦⑨元素的非金属性性依次减弱(填金属性、非金属性),⑤的氧化物是两性氧化物(填酸性、碱性或两性),写出其与③的氧化物水化物反应的化学方程式:Al2O3+2NaOH=2NaAlO2+H2O.
| ① | ② | ||||||
| ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| ⑧ | ⑨ |

(2)元素①③⑧最外层电子数都为1,在周期表中在同一列,称为碱金属元素,③的金属性<⑧的金属性(填>、=、<).
(3)②⑦⑨元素的非金属性性依次减弱(填金属性、非金属性),⑤的氧化物是两性氧化物(填酸性、碱性或两性),写出其与③的氧化物水化物反应的化学方程式:Al2O3+2NaOH=2NaAlO2+H2O.
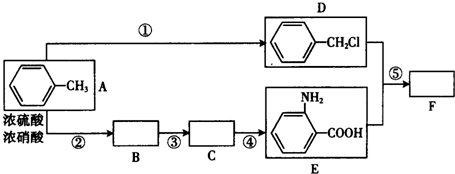
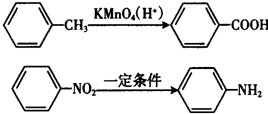
 .
. .
.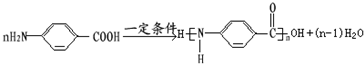 .
.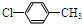 (写结构简式).
(写结构简式).