题目内容
下列叙述正确是的( )
| A、人工固氮的过程一定涉及到氧化还原反应 |
| B、1mol氯气在反应中一定得到2mol电子 |
| C、1mol钠在足量氧气中燃烧生成Na2O2,失去2mol电子 |
| D、发生化学反应时,失去电子越多的金属原子,还原能力越强 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:A.人工固氮的过程,N元素由游离态转化为化合态;
B.氯气在反应中可能为氧化剂,也为还原剂;
C.反应中Na元素的化合价由0升高为+1价;
D.失去电子的多少与还原性无关.
B.氯气在反应中可能为氧化剂,也为还原剂;
C.反应中Na元素的化合价由0升高为+1价;
D.失去电子的多少与还原性无关.
解答:
解:A.人工固氮的过程,N元素由游离态转化为化合态,N元素的化合价一定变化,则一定为氧化还原反应,故A正确;
B.氯气在反应中可能为氧化剂,也为还原剂,如1mol氯气与NaOH反应时,转移电子为1mol,故B错误;
C.反应中Na元素的化合价由0升高为+1价,则1mol钠在足量氧气中燃烧生成Na2O2,失去1mol电子,故C错误;
D.失去电子的多少与还原性无关,还原性与失去电子的难易有关,故D错误;
故选A.
B.氯气在反应中可能为氧化剂,也为还原剂,如1mol氯气与NaOH反应时,转移电子为1mol,故B错误;
C.反应中Na元素的化合价由0升高为+1价,则1mol钠在足量氧气中燃烧生成Na2O2,失去1mol电子,故C错误;
D.失去电子的多少与还原性无关,还原性与失去电子的难易有关,故D错误;
故选A.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及元素化合价及转移电子的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
下列各组离子在水溶液中能够大量共存的是( )
| A、OH-、SO42-、Fe3+ |
| B、NH4+、OH-、NO3- |
| C、Na+、Cl-、SO42- |
| D、H+、HCO3-、K+ |
FeO/Fe3O4广泛用于热化学循环分解水制取氢气.已知:H2O(g)+3FeO
Fe3O4+H2 (g)…①2Fe3O4
6FeO+O2 (g)…②下列说法正确的是( )
| ||
| ||
| A、反应①、②均是置换反应 |
| B、反应①中FeO被还原 |
| C、反应②中铁元素的化合价升高 |
| D、反应②中Fe3O4既是氧化剂又是还原剂 |
胶体是一种重要的分散系.下列关于胶体的说法错误的是( )
| A、制备Fe(OH)3胶体的方法是在浓FeCl3溶液中加入大量浓NaOH溶液,并不断搅拌 |
| B、Fe(OH)3胶体中的胶体粒子大小在1~100nm之间 |
| C、可用丁达尔效应区分Fe(OH)3胶体和蔗糖溶液 |
| D、当光束通过有尘埃的空气或稀豆浆时都能观察到丁达尔效应 |
关于NaCl溶液和Fe(OH)3胶体描述正确的是( )
| A、两者都能产生丁达尔现象 |
| B、两者都不能产生丁达尔现象 |
| C、NaCl溶液能产生丁达尔现象,Fe(OH)3胶体不能产生丁达尔现象 |
| D、NaCl溶液不能产生丁达尔效应,Fe(OH)3胶体能产生丁达尔现象 |
 是一种的香精素,有关合成路线如下:
是一种的香精素,有关合成路线如下:
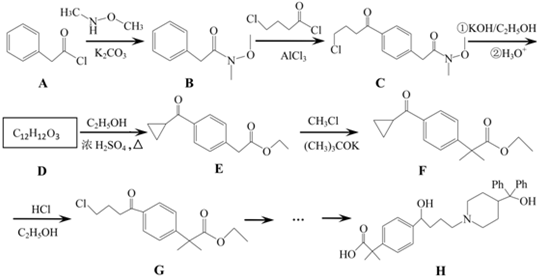
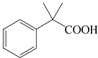 是一种重要的有机合成中间体,请完成以苯乙烯为主要原料(其他试剂自选)合成该化合物的合成路线流程图.合成路线流程图示例如下:H2C=CH2
是一种重要的有机合成中间体,请完成以苯乙烯为主要原料(其他试剂自选)合成该化合物的合成路线流程图.合成路线流程图示例如下:H2C=CH2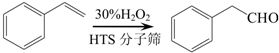 →
→