题目内容
4.在酸性溶液中含Ba2+的溶液中,还能大量存在的离子是( )| A. | OH- | B. | HCO3- | C. | Cl- | D. | SO42- |
分析 酸性溶液中存在大量氢离子,氢离子与氢氧根离子、碳酸氢根离子反应,钡离子与硫酸根离子反应,在溶液中不能大量共存,只有氯离子能够共存,据此进行解答.
解答 解:A.OH-与酸性溶液中的氢离子反应,在溶液中不能大量共存,故A错误;
B.HCO3-与酸性溶液中氢离子反应,在溶液中不能大量共存,故B错误;
C.Cl-不与氢离子、Ba2+反应,在溶液中能够大量共存,故C正确;
D.SO42-与Ba2+反应生成硫酸钡沉淀,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
15.下列物质都能导电,其中属于电解质的是( )
| A. | NaCl溶液 | B. | NH3 | C. | 稀硫酸 | D. | 熔融的NaOH |
12.在标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1L水中,所得溶液的密度为ρg/cm3,则此溶液的物质的量浓度为( )
| A. | $\frac{ρV}{MV+2240}$mol/L | B. | $\frac{1000ρV}{MV+2240}$mol/L | ||
| C. | $\frac{MV}{22.4V+0.1ρ}$mol/L | D. | $\frac{V}{2.24}$mol/L |
19.阿伏加德罗常数值是NA,标准状况下,若某氧气和氮气的混合气体mg含有b个分子,则ng该混合气体在标准状况下的体积是( )
| A. | $\frac{22.4nb}{m{N}_{A}}$ | B. | $\frac{22.4mb}{n{N}_{A}}$ | C. | $\frac{22.4n{N}_{A}}{mb}$ | D. | nbN$\frac{nb{N}_{A}}{22.4m}$ |
9.在2L的恒容容器中,充入1molA和3molB,并在一定条件下发生如下反应:A(g)+3B(g)?2C(g);经3s后达到平衡,测得C气体的浓度为0.6mol•L-1,下列说法中不正确的是( )
| A. | 用A表示反应的速率为0.1 mol•L-1•s-1 | |
| B. | 用B表示反应速率为0.4 mol•L-1•s-1 | |
| C. | 3s时生成C的物质的量为1.2mol | |
| D. | 3s时B的浓度为0.6mol•L-1 |
16.在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
| A. | V (N2)=0.2 mol•L-1•min-1 | B. | V (N2)=0.1 mol•L-1•min-1 | ||
| C. | V (NH3)=0.1 mol•L-1•min-1 | D. | V (H2)=0.3 mol•L-1•min-1 |
13.下列各组物质互相作用时,生成物不随反应条件或反应物的量变化而变化的是( )
| A. | NaHCO3溶液和NaOH溶液 | B. | NaOH溶液和CO2 | ||
| C. | Na和O2 | D. | Na2CO3溶液和盐酸 |
14.某溶液中,滴加KSCN溶液时无明显现象发生,再滴入少量氯水,溶液立即显红色.则原溶液中可能含有( )
| A. | Na+ NH4+ Cl- | B. | Fe3+Fe2+SO42- | ||
| C. | K+Fe3+NO3- | D. | Na+Fe2+ Cl- |
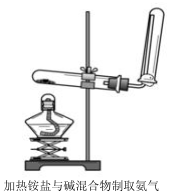 实验室一般采用如下装置制取氨气,按要求回答下列问题:
实验室一般采用如下装置制取氨气,按要求回答下列问题: