题目内容
5.下列关于σ键和π键的理解不正确的是( )| A. | 共价单键都是σ键,共价双键中有一个σ键和一个π键 | |
| B. | σ键可以绕键轴旋转,π键一定不能绕键轴旋转 | |
| C. | H2 分子中的σ键是s-s σ键,HClO分子中的σ键是p-p σ键 | |
| D. | C2H4分子中有5个σ键和一个π键,N2H4中只有5个σ键 |
分析 A.单键为σ键,双键、三键中均含1个σ键;
B.σ键为球对称,π键为镜面对称;
C.HCl中为H的1s轨道与Cl的3p轨道形成的s-pσ键;
D.稀有气体的单质中不存在共价键.
解答 解:A.分子中单键中只含σ键,双键和三键中含π键和σ键,所以π键一定不能单独形成,故A正确;
B.σ键为球对称,π键为镜面对称,则σ键可以绕键轴旋转,π键一定不能绕键轴旋转,故B正确;
C.H只有1s电子,Cl的3p轨道上的电子与H的1s轨道电子以“头碰头”方式重叠构建s-pσ键,故C错误;
D.乙烯分子中氢原子和原子之间存在共价单键,为σ键,碳碳原子之间存在共价双键,一个是σ键和一个是π键,C2H4分子中有5个σ键和一个π键,N2H4中只有5个单键,即含有5个σ键,故D正确;
故选C.
点评 本题考查共价键的形成及类型,注意σ键、π键的形成过程及判断的一般规律即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
16.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 46 g NO2含有氧原子数为2NA | |
| B. | 常温常压下,22.4 L N2含有的分子数为NA | |
| C. | 1 L 1 mol•L-1 Al2(SO4)3溶液中含SO${\;}_{4}^{2-}$数目为NA | |
| D. | 1 mol Fe在足量Cl2中燃烧,转移电子数为2NA |
13.青奥中心外墙的复合保温材料采用铝合金锁边.有关铝合金的性质正确的是( )(填字母).
| A. | 强度小 | B. | 耐腐蚀 | C. | 密度大 |
10.下列化合物中含有2个手性碳原子的是( )
| A. |  | B. |  | C. |  | D. | 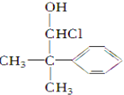 |

 CO3;③三个钙原子3Ca.
CO3;③三个钙原子3Ca.

 Ⅰ.某学习小组用乙醇与氢溴酸为原料制备溴乙烷.
Ⅰ.某学习小组用乙醇与氢溴酸为原料制备溴乙烷.