题目内容
10.2.3g某有机物A完全燃烧后,生成0.1mol CO2和 2.7gH2O,测得该化合物的蒸气与空气的相对密度是1.6,已知此有机物可以发生催化氧化反应,写出此反应的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.分析 根据有机物A的蒸气与空气的相对密度是1.6计算A的相对分子质量,根据质量守恒定律判断3g有机物中是否含有O元素,并计算O原子的质量,进而计算C、H、O的物质的量比值,结合相对分子质量可得该有机物的化学式,书写可能的结构简式.
解答 解:n(CO2)=0.1mol,则2.3g有机物中:n(C)=n(CO2)=0.1mol,m(C)=0.1mol×12g/mol=1.2g,
n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,则2.3g有机物中:n(H)=2n(H2O)=0.3mol,m(H)=0.3mol×1g/mol=0.3g,
因(1.2g+0.3g)<2.3g,所以有机物中还应还用O元素,且m(O)=2.3g-1.2g-0.3g=0.8g,n(O)=$\frac{0.8g}{16g/mol}$=0.05mol,
该化合物的蒸气与空气的相对密度是1.6,则有机物A的相对分子质量=29×1.6=46,有机物A中:n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6:1,所以该有机物的最简式为C2H6O,而C2H6O的相对分子质量为46,所以该有机物的分子式为C2H6O,有机物可以发生催化氧化反应,所以有机物为乙醇,乙醇催化氧化,生成乙醛和水,反应方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
点评 本题考查有机物分子式的确定,难度不大,根据质量守恒判断有机物中是否含有O元素是解答关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
1.下表是部分短周期元素的原子半径及主要化合价:
试回答下列问题:
(1)五种元素中原子半径最大的元素在周期表中位置是第三周期IA族.
(2)Y的氢化物比Q的氢化物沸点高的原因是NH3的分子间存在氢键.
(3)X或与R按1:1的原子个数比形成化合物甲,甲中存在的化学键有离子键和非极性键(或离子键,共价键;X可与W组成含18e-的化合物乙,则乙的电子式为 ;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键.1mol丙气体可与2mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式O=C=C=C=O.
;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键.1mol丙气体可与2mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式O=C=C=C=O.
| 元素代号 | W | R | X | Y | Z | Q |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.110 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2、+4 | -3、+5 |
(1)五种元素中原子半径最大的元素在周期表中位置是第三周期IA族.
(2)Y的氢化物比Q的氢化物沸点高的原因是NH3的分子间存在氢键.
(3)X或与R按1:1的原子个数比形成化合物甲,甲中存在的化学键有离子键和非极性键(或离子键,共价键;X可与W组成含18e-的化合物乙,则乙的电子式为
 ;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键.1mol丙气体可与2mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式O=C=C=C=O.
;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键.1mol丙气体可与2mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式O=C=C=C=O.
18.锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族.
(1)碱性:Sr(OH)2<Ba(OH)2(填“>”或“<”);用原子结构的观点解释其原因是同一主族元素,原子最外层电子数相同,原子核外电子层数逐渐增大,原子半径逐渐增大,原子失去电子的能力逐渐增强.
(2)碳酸锶是最重要的锶化合物.用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入稀硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3.
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH
①Ⅰ中,反应的化学方程式是SrSO4+Na2CO3=SrCO3+Na2SO4 .
②Ⅱ中,能与盐酸反应溶解的物质有BaSO4和SiO2.
③Ⅳ的目的是将Fe2+氧化为Fe3+,同时可以使Fe 3+和Al 3+沉淀完全.
④下列关于该工艺流程的说法正确的是ab.
a.该工艺产生的废液含较多的NH4+、Na+、Cl-、SO42-
b.Ⅴ中反应时,加入NaOH溶液一定可以提高NH4HCO3的利用率.
(1)碱性:Sr(OH)2<Ba(OH)2(填“>”或“<”);用原子结构的观点解释其原因是同一主族元素,原子最外层电子数相同,原子核外电子层数逐渐增大,原子半径逐渐增大,原子失去电子的能力逐渐增强.
(2)碳酸锶是最重要的锶化合物.用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入稀硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3.
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
②Ⅱ中,能与盐酸反应溶解的物质有BaSO4和SiO2.
③Ⅳ的目的是将Fe2+氧化为Fe3+,同时可以使Fe 3+和Al 3+沉淀完全.
④下列关于该工艺流程的说法正确的是ab.
a.该工艺产生的废液含较多的NH4+、Na+、Cl-、SO42-
b.Ⅴ中反应时,加入NaOH溶液一定可以提高NH4HCO3的利用率.
5.下列物质所含粒子数为0.1NA(NA为阿伏伽德罗常数的值)的是( )
| A. | 1L 0.1mol•L-1氨水中的NH4+ | |
| B. | 0.1mol Na2O2 所含的阴离子 | |
| C. | 12.5mL 16 mol•L-1的浓硫酸能溶解的Cu | |
| D. | 18g H2O中含NA个质子 |
2.用NA表示阿状加德罗常数,下列说法正确的是( )
| A. | 78g Na2O2与足量水反应中电子转移了0.2NA | |
| B. | 60g丙醇中存在的共价键总数为10NA | |
| C. | 分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有(不含立体异构)4种 | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
19.下列实验操作中正确的是( )
| A. | 蒸发时,只要蒸发皿中出现固体,立即停止加热 | |
| B. | 蒸馏时,温度计水银球应插入液体中,但不能碰到烧瓶内壁 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 焰色反应时,用稀硫酸洗净铂丝,并在火焰上灼烧至无色 |
20.下列反应的离子方程式正确的是( )
| A. | 铝片跟氢氧化钠溶液反应:Al+4OH-═[Al(OH)4]-+H2↑ | |
| B. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 氯化铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 铜片跟稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O |
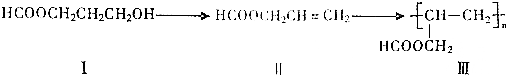
 .
.