题目内容
下列物质在一定条件下可以使紫色石蕊试液褪色,且漂白原理相同的是( )
①次氯酸钠 ②活性炭 ③浓硝酸 ④稀硝酸 ⑤过氧化钠.
①次氯酸钠 ②活性炭 ③浓硝酸 ④稀硝酸 ⑤过氧化钠.
| A、①③⑤ | B、①④⑤ |
| C、②④⑤ | D、①③④ |
考点:氯、溴、碘及其化合物的综合应用,硝酸的化学性质,钠的重要化合物
专题:卤族元素
分析:可以使紫色石蕊试液褪色,有些物质因为其强氧化性而具有漂白性,有些物质因为其吸附性而具有漂白性,据此分析解答.
解答:
解:①次氯酸钠、③浓硝酸、⑤过氧化钠都具有强氧化性,能将某些有色物质氧化而具有漂白性,可以使紫色石蕊试液褪色;
②活性炭多孔而具有吸附性,能吸附某些有色气体而具有漂白性;
④稀硝酸具有酸性使石蕊试液变红色;
所以其漂白原理相同的是:①次氯酸钠、③浓硝酸、⑤过氧化钠;
故选A.
②活性炭多孔而具有吸附性,能吸附某些有色气体而具有漂白性;
④稀硝酸具有酸性使石蕊试液变红色;
所以其漂白原理相同的是:①次氯酸钠、③浓硝酸、⑤过氧化钠;
故选A.
点评:本题考查了物质漂白性,明确漂白原理是解本题关键,注意物质性质的分析判断,原理的理解应用,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
为证明某可溶性一元酸(HX)是弱酸,某同学设计了如下实验方案,其中不 合理的是( )
| A、室温下,测0.1 mol/L HX溶液的pH>1,证明HX是弱酸 |
| B、室温下,将等浓度等体积的盐酸和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 |
| C、室温下,测1 mol/L NaX的pH,若pH>7,证明HX是弱酸 |
| D、在相同条件下,对0.1 mol/L的盐酸和0.1 mol/L的HX溶液进行导电性实验,若HX溶液灯泡较暗,证明HX为弱酸 |
分类是化学研究的重要方法,下列各组物质的分类正确的是( )
| A、同位素:D2、H2、T2 |
| B、含极性键、由分子构成的化合物:CO2、CCl4、NH3 |
| C、非电解质:NH3、C2H5OH、Cl2 |
D、同系物: |
下列各组离子在指定的环境中一定能大量存在的是( )
| A、pH=1的溶液中:S2O32-、Cu2+、Na+、Cl- |
| B、能使酚酞变红色的溶液中:Na+、K+、S2-、HCO3- |
| C、加入铝粉能产生H2的溶液中:NH4+、Na+、Fe2+、NO3- |
| D、使甲基橙变黄色的溶液中:Na+、K+、Cl-、SO42- |
下列图所示的实验操作中,不正确的是( )
A、 滴加液体药品 |
B、 过滤 |
C、 稀释浓硫酸 |
D、 读取液体的体积 |
不能用于判断HA是弱电解质(弱酸)的依据是( )
| A、浓度相等的HCl与HA,跟锌反应生成氢气的速率HCl比HA快 |
| B、pH相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多 |
| C、浓度相等的NaCl与NaA两溶液,前者是中性而后者为碱性 |
| D、浓度相等体积相同的HCl与HA两溶液与足量氢氧化钠溶液反应时,消耗的氢氧化钠一样多 |
已知,单质碘受热易升华.从海带中提取碘的实验过程中,涉及下列实验操作步骤,关于各步骤的实验目的或实验操作,描述正确的是( )
A、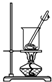 将海带灼烧成灰 |
B、 过滤得含I-的溶液 |
C、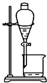 下层放出碘的苯溶液 |
D、 分离碘并回收苯 |
 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.