题目内容
氨、氯气和溴是中学化学实验中的常见试剂:
(1)实验室利用反应:2NH3+3CuO
N2+3Cu+3H2O中反应物CuO和生成物H2O的质量可以测定铜的近似相对原子质量,实验装置(加热及夹持装置未画出)如下.实验开始时,应先点燃 (填“A”、“B”)处酒精灯;c中碱石灰的作用为 .

上述装置设计尚存在缺陷,应在 (填上述仪器字母序号)之间再加一个装置,请画出该装置(注明所需试剂).
(2)实验室用Cl2从盐湖苦卤(富含K+、Ca2+、Mg2+、Br-、SO42-、Cl-等)中提取较纯净的氯化钾晶体及液溴,流程如下:

①步骤I中液体静置分层后,从分液漏斗中分离出无色溶液A的具体操作过程为 .
②加入试剂x的目的是 ;步骤Ⅳ中试剂y的化学式为 ;
③步骤v中蒸发溶液D时需要的仪器除酒精灯、三脚架外还需 .
(3)Br2和FeCl3的稀溶液均呈黄色.将少量稀溴水滴入稀FeCl2溶液得黄色溶液,某同学设计实验验证二者混合能否发生反应:取少量混合溶液,加入淀粉碘化钾溶液,振荡溶液变蓝色,则二者未发生化学反应.该实验设计不正确,错误在于 .设计合理实验检验溴水和FeCl2溶液是否发生化学反应(简要说明实验步骤、现象和结论) .
(1)实验室利用反应:2NH3+3CuO
| ||

上述装置设计尚存在缺陷,应在
(2)实验室用Cl2从盐湖苦卤(富含K+、Ca2+、Mg2+、Br-、SO42-、Cl-等)中提取较纯净的氯化钾晶体及液溴,流程如下:

①步骤I中液体静置分层后,从分液漏斗中分离出无色溶液A的具体操作过程为
②加入试剂x的目的是
③步骤v中蒸发溶液D时需要的仪器除酒精灯、三脚架外还需
(3)Br2和FeCl3的稀溶液均呈黄色.将少量稀溴水滴入稀FeCl2溶液得黄色溶液,某同学设计实验验证二者混合能否发生反应:取少量混合溶液,加入淀粉碘化钾溶液,振荡溶液变蓝色,则二者未发生化学反应.该实验设计不正确,错误在于
考点:氨的制取和性质,海水资源及其综合利用
专题:实验题,实验设计题
分析:(1)装置内含有空气,应先点燃A处酒精灯用产生的氨气排尽装置内的空气;氨气与氧化铜反应生成水,用碱石灰吸收反应生成的水;氯化铵与氢氧化钙反应生成的氨气中含有水,进入B中容易炸裂试管,所以应先干燥氨气除去水蒸气;
(2)①依据分液漏斗的正确使用方法解答,分液时下层液体应从下口流出,上层液体从上口倒出;
②要提取较纯净的氯化钾晶体,应除去杂质离子:Ca2+、Mg2+、SO42-,加入氯化钡可以除去硫酸根离子,然后加入氧化钙与水反应生成氢氧化钙,除去镁离子,最后加入碳酸钾除去过了的钡离子和氢氧根离子;
③蒸发操用的仪器有酒精度、三脚架、蒸发皿、玻璃棒,据此解答;
(3)溴单质和三价铁离子都能够氧化碘离子生成单质碘,判断溴水和FeCl2溶液是否反应的最简单方法是只需检验有无三价铁离子生成.
(2)①依据分液漏斗的正确使用方法解答,分液时下层液体应从下口流出,上层液体从上口倒出;
②要提取较纯净的氯化钾晶体,应除去杂质离子:Ca2+、Mg2+、SO42-,加入氯化钡可以除去硫酸根离子,然后加入氧化钙与水反应生成氢氧化钙,除去镁离子,最后加入碳酸钾除去过了的钡离子和氢氧根离子;
③蒸发操用的仪器有酒精度、三脚架、蒸发皿、玻璃棒,据此解答;
(3)溴单质和三价铁离子都能够氧化碘离子生成单质碘,判断溴水和FeCl2溶液是否反应的最简单方法是只需检验有无三价铁离子生成.
解答:
解:(1)应先点燃A处酒精灯用产生的氨气排尽装置内的空气;氨气与氧化铜反应生成水,c中碱石灰的作用为吸收
生成的水;氯化铵与氢氧化钙反应生成的氨气中含有水,进入B中容易炸裂试管,在AB之间加一个盛有碱石灰的干燥管吸收生成的水,防止B试管炸裂;图为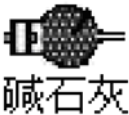 ,
,
故答案为:A; 吸收反应生成的水;AB; ;
;
(2)①分液时下层液体应从下口流出,上层液体从上口倒出,所以步骤I中液体静置分层后,从分液漏斗中分离出无色溶液A的具体操作过程为:先打开分液漏斗上口玻璃塞,或者使塞上凹槽对准漏斗上的小孔,在拧开分液漏斗下端的活塞,使下层液体慢慢沿烧杯壁流下当下层液体流完后迅速关闭活塞,将无色液体A从上口到处;
故答案为:先打开分液漏斗上口玻璃塞,或者使塞上凹槽对准漏斗上的小孔,在拧开分液漏斗下端的活塞,使下层液体慢慢沿烧杯壁流下当下层液体流完后迅速关闭活塞,将无色液体A从上口到处;
②要提取较纯净的氯化钾晶体,应除去杂质离子:Ca2+、Mg2+、SO42-,加入氯化钡可以除去硫酸根离子,然后加入氧化钙与水反应生成氢氧化钙,除去镁离子,最后加入碳酸钾除去过了的钡离子和氢氧根离子;
故答案为:除去硫酸根;K2CO3;
③蒸发溶液D时需要的仪器除酒精灯、三脚架外还需:蒸发皿、玻璃棒;
故答案为:蒸发皿、玻璃棒;
(3)溶液变蓝色,说明有碘单质生成,Br2和Fe3+均可以把I?氧化为碘单质,所以无法判断,判断溴水和FeCl2溶液是否反应的最简单方法是只需检验有无三价铁离子生成就可以证明发生反应,方法为:取少量黄色溶液,滴加KSCN溶液,若溶液变成红色(血红色),则说明溴水和FeCl2溶液发生了反应;
故答案为:溴单质和三价铁离子都能够氧化碘离子生成单质碘,使溶液变蓝,无法得出结论;
取少量黄色溶液,滴加KSCN溶液,若溶液变成红色(血红色),则说明溴水和FeCl2溶液发生了反应.
生成的水;氯化铵与氢氧化钙反应生成的氨气中含有水,进入B中容易炸裂试管,在AB之间加一个盛有碱石灰的干燥管吸收生成的水,防止B试管炸裂;图为
 ,
,故答案为:A; 吸收反应生成的水;AB;
 ;
;(2)①分液时下层液体应从下口流出,上层液体从上口倒出,所以步骤I中液体静置分层后,从分液漏斗中分离出无色溶液A的具体操作过程为:先打开分液漏斗上口玻璃塞,或者使塞上凹槽对准漏斗上的小孔,在拧开分液漏斗下端的活塞,使下层液体慢慢沿烧杯壁流下当下层液体流完后迅速关闭活塞,将无色液体A从上口到处;
故答案为:先打开分液漏斗上口玻璃塞,或者使塞上凹槽对准漏斗上的小孔,在拧开分液漏斗下端的活塞,使下层液体慢慢沿烧杯壁流下当下层液体流完后迅速关闭活塞,将无色液体A从上口到处;
②要提取较纯净的氯化钾晶体,应除去杂质离子:Ca2+、Mg2+、SO42-,加入氯化钡可以除去硫酸根离子,然后加入氧化钙与水反应生成氢氧化钙,除去镁离子,最后加入碳酸钾除去过了的钡离子和氢氧根离子;
故答案为:除去硫酸根;K2CO3;
③蒸发溶液D时需要的仪器除酒精灯、三脚架外还需:蒸发皿、玻璃棒;
故答案为:蒸发皿、玻璃棒;
(3)溶液变蓝色,说明有碘单质生成,Br2和Fe3+均可以把I?氧化为碘单质,所以无法判断,判断溴水和FeCl2溶液是否反应的最简单方法是只需检验有无三价铁离子生成就可以证明发生反应,方法为:取少量黄色溶液,滴加KSCN溶液,若溶液变成红色(血红色),则说明溴水和FeCl2溶液发生了反应;
故答案为:溴单质和三价铁离子都能够氧化碘离子生成单质碘,使溶液变蓝,无法得出结论;
取少量黄色溶液,滴加KSCN溶液,若溶液变成红色(血红色),则说明溴水和FeCl2溶液发生了反应.
点评:本题为实验题,考查了氨气的实验室制法、海水提溴和氯化镁、溴单质和三价铁离子的性质,题目难度较大,熟悉反应的原理和物质的性质是解题关键,侧重学生分析问题、解决问题的能力培养.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
下列物质的水溶液,呈酸性的是( )
| A、Na2CO3 |
| B、Na2SO4 |
| C、KNO3 |
| D、NH4NO3 |

