题目内容
高锰酸钾在饮用水和工业污水处理领域的消费增长较快.实验室可用软锰矿(主要成分MnO2)为原料制备高锰酸钾.其部分流程如下:

已知:①流程中所加软锰矿中含50g MnO2;
②生成墨绿色浸出液的反应为:KClO3+3MnO2+6KOH═3K2MnO4+KCl+3H2O.回答下列问题:
(1)实验中采用铁坩埚而不用瓷坩埚的原因是 .
(2)写出通入CO2,可使MnO42-发生反应,生成MnO4-及MnO2的离子方程式: ;若通入CO2太多,则在加热浓缩时,会有 晶体和KMnO4晶体一起析出.
(3)在加热、浓缩、烘干的过程中温度不宜过高,其原因是 ;趁势过滤的目的 ;加热时用玻璃棒不断搅拌溶液的目的是 ;洗涤KMnO4晶体用冷水洗涤较好的原因是 .
(4)计算12.25g KClO3固体经过上述转化,最多可制得KMnO4的质量为 (结果保留一位小数).

已知:①流程中所加软锰矿中含50g MnO2;
②生成墨绿色浸出液的反应为:KClO3+3MnO2+6KOH═3K2MnO4+KCl+3H2O.回答下列问题:
(1)实验中采用铁坩埚而不用瓷坩埚的原因是
(2)写出通入CO2,可使MnO42-发生反应,生成MnO4-及MnO2的离子方程式:
(3)在加热、浓缩、烘干的过程中温度不宜过高,其原因是
(4)计算12.25g KClO3固体经过上述转化,最多可制得KMnO4的质量为
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:KOH、KClO3、MnO2共熔制得绿色K2MnO4,通入CO2,可使MnO42-发生歧化反应,生成MnO4-及MnO2,若通入CO2太多,会生KHCO3,滤液中含有KHCO3、KMnO4,经过滤、洗涤、加热、浓缩、烘干可得到高锰酸钾,
(1)瓷坩埚原料含有SiO2,在高温下,瓷坩埚可以和KOH发生反应SiO2+2KOH═K2SiO3+H2O;
(2)通入CO2,可使MnO42-发生歧化反应,生成MnO4-及MnO2,若通入CO2太多,会生KHCO3;
(3)KMnO4在温度过高的条件下会发生分解反应,故在加热、浓缩、烘干的过程中温度不宜过高,温度降低,物质的溶解度降低,混合液趁热过滤,减少产品的损失,提高产率,使用玻璃棒搅拌,可以使溶液受热均匀,有利于蒸发溶剂,洗涤KMnO4晶体用冷水洗涤较好的原因是防止高锰酸钾溶解;
(4)根据反应的关系式计算.
(1)瓷坩埚原料含有SiO2,在高温下,瓷坩埚可以和KOH发生反应SiO2+2KOH═K2SiO3+H2O;
(2)通入CO2,可使MnO42-发生歧化反应,生成MnO4-及MnO2,若通入CO2太多,会生KHCO3;
(3)KMnO4在温度过高的条件下会发生分解反应,故在加热、浓缩、烘干的过程中温度不宜过高,温度降低,物质的溶解度降低,混合液趁热过滤,减少产品的损失,提高产率,使用玻璃棒搅拌,可以使溶液受热均匀,有利于蒸发溶剂,洗涤KMnO4晶体用冷水洗涤较好的原因是防止高锰酸钾溶解;
(4)根据反应的关系式计算.
解答:
解:KOH、KClO3、MnO2共熔制得绿色K2MnO4,通入CO2,可使MnO42-发生歧化反应,生成MnO4-及MnO2,若通入CO2太多,会生KHCO3,滤液中含有KHCO3、KMnO4,经过滤、洗涤、加热、浓缩、烘干可得到高锰酸钾,
(1)瓷坩埚原料含有SiO2,在高温下,瓷坩埚可以和KOH发生反应SiO2+2KOH═K2SiO3+H2O,腐蚀瓷坩埚,故不能使用瓷坩埚,而使用铁坩埚,
故答案为:在高温下,瓷坩埚可以和KOH发生反应SiO2+2KOH═K2SiO3+H2O,腐蚀瓷坩埚;
(2)通入CO2,可使MnO42-发生歧化反应,生成MnO4-及MnO2,反应的离子方程式为3MnO42-+2CO2=2MnO4-+MnO2+2CO32-,工艺流程可知,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,若通入CO2太多,会生KHCO3,
故答案为:3MnO42-+2CO2=2MnO4-+MnO2+2CO32-;KHCO3;
(3)KMnO4在温度过高的条件下会发生分解反应,故在加热、浓缩、烘干的过程中温度不宜过高,温度降低,物质的溶解度降低,混合液趁热过滤,减少产品的损失,提高产率,使用玻璃棒搅拌,可以使溶液受热均匀,有利于蒸发溶剂,洗涤KMnO4晶体用冷水洗涤较好的原因是防止高锰酸钾溶解,
故答案为:温度过高会导致KMnO4分解;防止KMnO4结晶析出;受热均匀,有利于蒸发溶剂;减少高锰酸钾的溶解;
(4)设计反应分别为KClO3+3MnO2+6KOH═3K2MnO4+KCl+3H2O、3MnO42-+3CO2+2OH-=2MnO4-+MnO2+3CO32-+H2O,可得关系式KClO3~2KMnO4,
122.5 2×158
12.25g m
m=2×15.8g=31.6g,
故答案为:31.6g.
(1)瓷坩埚原料含有SiO2,在高温下,瓷坩埚可以和KOH发生反应SiO2+2KOH═K2SiO3+H2O,腐蚀瓷坩埚,故不能使用瓷坩埚,而使用铁坩埚,
故答案为:在高温下,瓷坩埚可以和KOH发生反应SiO2+2KOH═K2SiO3+H2O,腐蚀瓷坩埚;
(2)通入CO2,可使MnO42-发生歧化反应,生成MnO4-及MnO2,反应的离子方程式为3MnO42-+2CO2=2MnO4-+MnO2+2CO32-,工艺流程可知,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,若通入CO2太多,会生KHCO3,
故答案为:3MnO42-+2CO2=2MnO4-+MnO2+2CO32-;KHCO3;
(3)KMnO4在温度过高的条件下会发生分解反应,故在加热、浓缩、烘干的过程中温度不宜过高,温度降低,物质的溶解度降低,混合液趁热过滤,减少产品的损失,提高产率,使用玻璃棒搅拌,可以使溶液受热均匀,有利于蒸发溶剂,洗涤KMnO4晶体用冷水洗涤较好的原因是防止高锰酸钾溶解,
故答案为:温度过高会导致KMnO4分解;防止KMnO4结晶析出;受热均匀,有利于蒸发溶剂;减少高锰酸钾的溶解;
(4)设计反应分别为KClO3+3MnO2+6KOH═3K2MnO4+KCl+3H2O、3MnO42-+3CO2+2OH-=2MnO4-+MnO2+3CO32-+H2O,可得关系式KClO3~2KMnO4,
122.5 2×158
12.25g m
m=2×15.8g=31.6g,
故答案为:31.6g.
点评:本题考查学生对工艺流程的理解、阅读获取信息能力、物质推断、氧化还原反应、工艺条件的控制等,难度中等,是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.

练习册系列答案
相关题目
下列物质属于非电解质的是( )
| A、BaSO4 |
| B、Cl2 |
| C、CH3COOH |
| D、CCl4 |


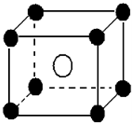 某离子晶体晶胞如图所示,阳离子 X(●)位于立方体的顶点,阴离子Y(○)位于立方体的中心,试分析:
某离子晶体晶胞如图所示,阳离子 X(●)位于立方体的顶点,阴离子Y(○)位于立方体的中心,试分析: