题目内容
15.盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同.试运用盖斯定律回答下列问题:①已知:H2O(g)═H2O(l)△H1=-Q1 kJ•mol-1
C2H5OH(g)═C2H5OH(l)△H2=-Q2kJ•mol-1
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3kJ•mol-1
若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为3Q1-Q2+Q3 kJ.
②C(s)在氧气供应不充足时会生成CO,但还是无法通过实验直接测得反应:C(s)+$\frac{1}{2}$O2(g)═CO(g)的△H,其原因是会有部分二氧化碳生成(或C不能完全转化为CO或其它合理答案).
分析 ①依据热化学方程式和盖斯定律计算所需热化学方程式,46g液态无水酒精物质的量=$\frac{46g}{46g/mol}$=1mol,以此可计算反应放出的热量;
②碳易与氧气反应生成二氧化碳,难以与氧气反应全部生成一氧化碳.
解答 解:①已知:a.H2O(g)═H2O(l)△H1=-Q1 kJ/mol,
b.C2H5OH(g)═C2H5OH(l)△H2=-Q2 kJ/mol,
c.C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3 kJ/mol,
依据盖斯定律计算3a+c-b得到液态无水酒精完全燃烧,生成气态CO2和液态H2O的热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H3=-( 3Q1-Q2+Q3) kJ/mol,46g液态无水酒精物质的量=$\frac{46g}{46g/mol}$=1mol,则完全燃烧,并恢复到室温,则整个过程中放出的热量为3Q1-Q2+Q3,
故答案为:3Q1-Q2+Q3;
②碳易与氧气反应部分生成二氧化碳,难以与氧气反应全部生成一氧化碳,导致无法测定反应热,
故答案为:会有部分二氧化碳生成(或C不能完全转化为CO或其它合理答案).
点评 本题考查了热化学方程式的书写方法,为高频考点,侧重考查学生的分析能力,注意把握盖斯定律的计算应用,掌握热化学方程式的意义和盖斯定律的应用是解题关键,题目难度中等.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
6.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构中每个原子均满足8电子结构,常温下,S2Cl2就是一种橙黄色的液体,易与水反应,并产生能使品红褪色的气体.下列说法中错误的是( )
| A. | S2Cl2中的硫元素显+1 价 | |
| B. | S2Cl2属于共价化合物 | |
| C. | S2Cl2与水的反应属于复分解反应 | |
| D. | S2Cl2与H2O反应的生成物中可能有S |
3.下列物质一定互为同系物的是( )
| A. | 12C和14C | B. | CH4和C2H6 | C. | C2H4和C3H6 | D. | O2和O3 |
20.下列有机反应属于加成反应的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+HBr→CH3CH2Br | ||
| C. |  +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$ +H2O +H2O | D. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O |
7. 在恒容密闭容器中加入一定量的反应物后存在下列平:CO(g)+H2O(g)?CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示,下列说法正确的是( )
在恒容密闭容器中加入一定量的反应物后存在下列平:CO(g)+H2O(g)?CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示,下列说法正确的是( )
 在恒容密闭容器中加入一定量的反应物后存在下列平:CO(g)+H2O(g)?CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示,下列说法正确的是( )
在恒容密闭容器中加入一定量的反应物后存在下列平:CO(g)+H2O(g)?CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示,下列说法正确的是( )| A. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | |
| B. | 在T2时,若反应处于状态D,则一定有ν正<ν逆 | |
| C. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1>K2 |
4.有关乙酸与甲酸甲酯的说法中不正确的是( )
| A. | 两者都可以和NaOH溶液反应 | B. | 可利用水将两者区分开 | ||
| C. | 两者互为同分异构体 | D. | 两者互为同系物 |
5.如图,将铁棒和碳棒用导线连接后插入稀硫酸中,构成原电池.下列叙述不正确的是( )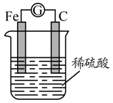

| A. | 电子从碳棒经导线流向铁棒 | B. | 铁棒是负极,碳棒是正极 | ||
| C. | 电池反应为:Fe+2H+=Fe2++H2↑ | D. | 碳棒上有气体放出,溶液c(H+)减小 |