题目内容
5.如图,将铁棒和碳棒用导线连接后插入稀硫酸中,构成原电池.下列叙述不正确的是( )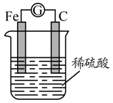
| A. | 电子从碳棒经导线流向铁棒 | B. | 铁棒是负极,碳棒是正极 | ||
| C. | 电池反应为:Fe+2H+=Fe2++H2↑ | D. | 碳棒上有气体放出,溶液c(H+)减小 |
分析 将铁棒和碳棒用导线连接后插入稀硫酸中,构成原电池,铁为负极,被氧化生成亚铁离子,碳为正极,发生还原反应,正极上生成氢气,以此解答该题.
解答 解:A.铁为负极,电子从铁经导线流向碳棒,故A错误;
B.活泼金属铁为负极,碳为正极,故B正确;
C.总反应为铁与氢离子的氧化还原反应,生成亚铁离子和氢气,方程式为Fe+2H+=Fe2++H2↑,故C正确;
D.氢离子在正极发生还原反应生成氢气,反应消耗氢离子,则溶液c(H+)减小,故D正确.
故选A.
点评 本题考查了原电池原理,为高频考点,侧重考查学生的分析能力,明确原电池的判断方法、正负极的判断、正负极上发生的反应即可解答,难度不大.

练习册系列答案
相关题目
16.设NA为阿伏加德罗常数的数值.下列有关叙述不正确的是( )
| A. | 44 g乙醛中所含的氧原子数为NA | |
| B. | 常温常压下,8gCH4含有5 NA个电子 | |
| C. | 标准状况下,22.4L苯含有NA个C6H6分子 | |
| D. | 14 g乙烯中所含的C-H键数目为2NA |
13.下列离子方程式书写正确的是( )
| A. | NaHSO4溶液中加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-═NH3↑+H2O | |
| C. | 往醋酸酸化的碘化钾溶液中滴加适量的双氧水:2I-+2H++H2O2═I2+2H2O | |
| D. | 氢硫酸里通入氯气:H2S+Cl2═2H++S↓+2Cl- |
20.密闭容器中充入1mol N2和3mol H2,一定条件下反应达平衡.下列说法正确的是( )
| A. | 生成2 mol NH3 | |
| B. | 正反应和逆反应的速率都为零 | |
| C. | N2、H2和NH3的物质的量浓度相等 | |
| D. | N2、H2和NH3的物质的量浓度不再变化 |
3.设 NA 为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,33.6 L 氟化氢中含有氟原子的数目为 1.5NA | |
| B. | 常温常压下,7.0 g 乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| C. | 50mL l8.4 mol/L 浓硫酸与足量铜微热反应,生成 SO2分子的数目为 0.46NA | |
| D. | 某密闭容器盛有0.lmolN2和0.3molH2,在一定条件下充分反应,转移电子的数 目为 0.6NA |
10.下列有关铝及其化合物的说法正确的是( )
| A. | 可用NaOH溶液除去Fe2O3中的Al2O3 | |
| B. | 铝表面有氧化膜保护,铝锅可以长时间盛放酸性溶液 | |
| C. | 氯化铝溶液与NaOH溶液互滴现象完全相同 | |
| D. | 实验室常用NaOH溶液和AlCl3溶液制备Al(OH)3 |
7. 如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细.由此判断表中所列M、N、P物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细.由此判断表中所列M、N、P物质,其中可以成立的是( )
 如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细.由此判断表中所列M、N、P物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细.由此判断表中所列M、N、P物质,其中可以成立的是( )| M | N | P | |
| A | Zn | Cu | 稀H2SO4溶液 |
| B | Cu | Fe | 稀HCl溶液 |
| C | Ag | Zn | AgNO3溶液 |
| D | Zn | Fe | CuSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
8.下列分子中,碳原子有sp3和sp2两种杂化轨道的是( )
| A. | 苯甲醛 | B. | 邻羟基苯甲酸 | C. | 乙二酸二乙酯 | D. | 1,3-丁二烯 |