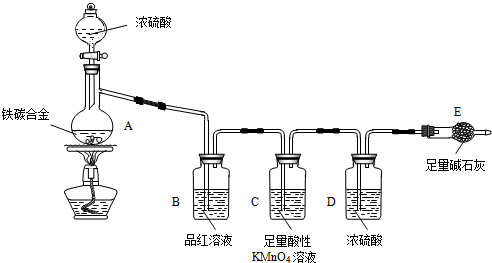
题目内容
11.常温下,pH=1的某溶液A中还含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如图所示: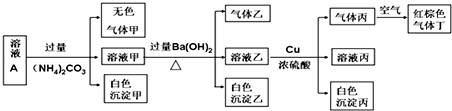
下列有关说法正确的是( )
| A. | 沉淀乙一定有BaCO3,可能有BaSO4 | |
| B. | 该溶液A中一定有NO3-、Al3+、SO42-、Cl- | |
| C. | 实验消耗Cu 14.4 g,则生成气体丙为3.36L | |
| D. | 生成的甲、乙、丙气体均为无色的易溶于水气体 |
分析 pH=1的某溶液中H+浓度为0.1mol/L,则说明溶液中无CO32-.
向溶液中加入过量的(NH4)2CO3溶液,生成的无色气体甲为CO2,生成的白色沉淀甲是CO32-和溶液中的弱碱阳离子双水解生成的,据此分析溶液中的离子.
向溶液中加入过量的Ba(OH)2溶液,生成的气体乙为NH3,由于(NH4)2CO3溶液能引入NH4+,故不能确定原溶液中含NH4+.
向溶液乙中加铜和硫酸,有遇空气变红棕色的气体丙生成,说明溶液中含NO3-.由于溶液显酸性,即含硝酸,则不能和硝酸共存的离子均不能存在.
由于前面加入了过量的Ba(OH)2溶液,故生成的白色沉淀丙为BaSO4,但SO42-是原溶液中就有的,还是后来加硫酸引入的,需要根据电荷守恒来判断.
解答 解:pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L.
由于pH=1的某溶液中H+浓度为0.1mol/L,则说明溶液中无CO32-.
向溶液中加入过量的(NH4)2CO3溶液,生成的无色气体甲为CO2,生成的白色沉淀甲是CO32-和溶液中的弱碱阳离子双水解生成的,由于生成的沉淀为白色,故此弱碱阳离子为Al3+,还能说明溶液中不含Fe3+、Fe2+;
向溶液中加入过量的Ba(OH)2溶液,生成的气体乙为NH3,由于前面加入的过量的(NH4)2CO3溶液能引入NH4+,故不能确定原溶液中含NH4+.
前面加入的过量的(NH4)2CO3溶液能引入CO32-,故生成的白色沉淀乙一定含BaCO3.
向溶液乙中加铜和硫酸,有遇空气变红棕色的气体丙生成,说明溶液中含NO3-.由于溶液显酸性,即含硝酸,则I-不能有.
综上分析可知,溶液中一定无CO32-、Fe3+、Fe2+、I-,一定含0.1mol/LH+、0.1mol/LAl3+、0、1mol/LNO3-,由于溶液必须显电中性,且除H+外只能含4种离子,故
溶液中一定含Cl-、SO42-.
即溶液中一定无NH4+、K+、Na+、CO32-、Fe3+、Fe2+、I-,一定含Cl-、SO42-、H+、Al3+、NO3-.
A.由于原溶液中含SO42-,故沉淀乙一定有BaCO3,也一定含BaSO4,故A错误;
B.由上述分析可知,该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子,故B正确;
C.实验消耗Cu 14.4g即0.225mol,设生成的气体丙NO的物质的量为xmol,根据得失电子数守恒可知:0.225mol×2=xmol×3,解得x=0.15mol,则0.15molNO在标准状况下体积为3.36L,但由于状态不明确,故NO的体积不一定是3.36L,故C错误;
D.甲为CO2,乙为NH3,甲、乙均为无色溶于水的气体,而丙为NO,NO为无色不溶于水的气体,故D错误;
故选B.
点评 本题考查无机物的推断及离子反应,为高频考点,把握实验流程中的反应、现象及离子推断为解答的关键,侧重分析与推断能力的考查,注意离子反应及元素化合物知识的综合应用,题目难度不大.

| A. | 过氧化钠和水反应 Na2O2+H2O=2Na++2OH-+O2↑ | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑ | |
| C. | Ca(ClO)2溶液中通入少量二氧化碳:ClO-+H2O+CO2=HClO+CO32- | |
| D. | 向氯化铝溶液中滴入足量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
| A. | 2NaCl(熔融)=2Na+Cl2↑ | B. | WO3+3H2 $\frac{\underline{\;\;△\;\;}}{\;}$W+3H2O | ||
| C. | Fe+CuSO4=Cu+FeSO4 | D. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ |
| A. | 原子半径:Y>Z>W | |
| B. | Z的最高价氧化物的水化物为强酸 | |
| C. | 非金属性最强的元素为W | |
| D. | XW2分子中各原子最外层电子均达到8电子结构 |
 ,如果要用这一反应方式合成:
,如果要用这一反应方式合成: ,则所用原料的名称是( )
,则所用原料的名称是( )| A. | 1-丁烯和2-乙基-1,3-丁二烯 | B. | 2-丁烯和2-甲基-1,3-丁二烯 | ||
| C. | 1-丙炔和2-乙基-1,3-丁二烯 | D. | 乙烯和2-甲基-1,3-丁二烯 |