题目内容
3.X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z的原子的最外层电子数之和均为9;单质Y和W均可与NaOH溶液反应.下列说法不正确的是( )| A. | 原子半径:Y>Z>W | |
| B. | Z的最高价氧化物的水化物为强酸 | |
| C. | 非金属性最强的元素为W | |
| D. | XW2分子中各原子最外层电子均达到8电子结构 |
分析 X原子的最外层电子数与次外层电子数相等,短周期中只有Be和Ar,此处显然X是Be;X与W最外层电子数之和为9,则W的最外层电子数为7,几种元素中W的原子序数最大,应为Cl元素,单质Y可与浓的NaOH溶液反应,可为Al或Si,则Z可为S或P,由题中其中只有两种为金属可知Y为Al,Z为S,根据元素周期律的递变规律和对应物质的性质解答该题.
解答 解:X原子的最外层电子数与次外层电子数相等,短周期中只有Be和Ar,此处显然X是Be;X与W最外层电子数之和为9,则W的最外层电子数为7,应为Cl元素,单质Y可与浓的NaOH溶液反应,可为Al或Si,则Z可为S或P,由题中其中只有两种为金属可知Y为Al,Z为S,
A.同周期元素原子半径随序数增大而减小规律,推知原子半径Cl<S<Al,即Y>Z>W,故A正确;
B.Z为S,Z的最高价氧化物对应的水化物为硫酸,为强酸,故B正确;
C.W为Cl,在四种元素中非金属性最强,故C正确;
D.XW2为BeCl2,Be原子最外层电子电子数为2,BeCl2中Be原子的最外层电子数为4,故D错误.
故选D.
点评 本题考查原子结构与元素的性质,题目难度中等,侧重于元素周期律的考查,注意根据原子结构特点判断元素的种类,为解答该题的关键,易错点为D,注意原子核外电子排布规律.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
13.下列说法不正确的是( )
| A. | 氧气和臭氧互为同素异形体 | |
| B. | CH3-CH2OH和 CH3-O-CH3互为同分异构体 | |
| C. | ${\;}_{2}^{3}$ He和${\;}_{2}^{4}$He互为同位素 | |
| D. | ${\;}_{2}^{4}$ He的最外层电子数为2,所以${\;}_{2}^{3}$He具有较强的金属性 |
11.常温下,pH=1的某溶液A中还含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如图所示:
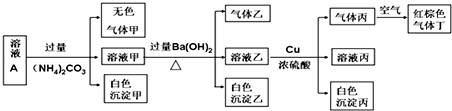
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 沉淀乙一定有BaCO3,可能有BaSO4 | |
| B. | 该溶液A中一定有NO3-、Al3+、SO42-、Cl- | |
| C. | 实验消耗Cu 14.4 g,则生成气体丙为3.36L | |
| D. | 生成的甲、乙、丙气体均为无色的易溶于水气体 |
8.下列说法不正确的是( )
| A. | 苯酚的俗称:石炭酸 | |
| B. | CH3COCH3分子中的官能团名称:醚键 | |
| C. | 葡萄糖的实验式:CH2O | |
| D. | 乙炔的结构简式:CH≡CH |
15.图一是维生素C的键线式结构.有关说法中错误的是( )


| A. | 图二不是维生素C的结构简式 | |
| B. | 维生素C在碱性溶液中不能稳定存在 | |
| C. | 维生素C易发生起氧化及加成反应 | |
| D. | 维生素C易溶于水 |
12.下列物质中,除一种外其余三种都具有相同的最简式,这种物质是( )
| A. | 乙酸已酯 | B. | 甲醛 | C. | 葡萄糖 | D. | 果糖 |