题目内容
Na2S2O3?5H2O(俗称海波或大苏打)是照相业常用的一种定影剂.常用下列途径制备海波:

已知反应:4FeS+7O2
2Fe2O3+4SO2、Na2SO3+S→Na2S2O3
①计算原料FeS在反应(a)和(b)中的理论分配比: .
②现有88g FeS,设NaOH溶液吸收SO2的吸收率为96%,问最多制备海波质量为 克(精确到0.1克).

已知反应:4FeS+7O2
| △ |
①计算原料FeS在反应(a)和(b)中的理论分配比:
②现有88g FeS,设NaOH溶液吸收SO2的吸收率为96%,问最多制备海波质量为
考点:含硫物质的性质及综合应用,化学方程式的有关计算
专题:氧族元素
分析:①设原料FeS在反应(a)和(b)中的物质的量分别为xmol、ymol,再根据方程式计算;
②利用S原子守恒计算.
②利用S原子守恒计算.
解答:
解:①设原料FeS在反应(a)和(b)中的物质的量分别为xmol、ymol,
4FeS+7O2=2Fe2O3+4SO2
x mol xmol
FeS+2HCl=H2S↑+FeCl2
ymol ymol
2H2S+SO2=3S+2H2O
ymol
mol
mol
SO2----->Na2SO3------>S----->Na2S2O3
(x-
)mol (x-
)mol
mol
mol
则 x-
mol=
mol,
解得
=
;
故答案为:
;
②制备过程中S原子守恒,设原料FeS在反应(a)和(b)中的物质的量分别为xmol、ymol;
则88x+88y=88g,
=
,
解得y=0.324
SO2----->Na2SO3------>S----->Na2S2O3?5H2O
mol
mol
则m(Na2S2O3?5H2O )=0.324mol×
×248g/mol=120.5g;
故答案为:120.5.
4FeS+7O2=2Fe2O3+4SO2
x mol xmol
FeS+2HCl=H2S↑+FeCl2
ymol ymol
2H2S+SO2=3S+2H2O
ymol
| y |
| 2 |
| 3y |
| 2 |
SO2----->Na2SO3------>S----->Na2S2O3
(x-
| y |
| 2 |
| y |
| 2 |
| 3y |
| 2 |
| 3y |
| 2 |
则 x-
| y |
| 2 |
| 3y |
| 2 |
解得
| x |
| y |
| 2 |
| 1 |
故答案为:
| 2 |
| 1 |
②制备过程中S原子守恒,设原料FeS在反应(a)和(b)中的物质的量分别为xmol、ymol;
则88x+88y=88g,
| x?96% |
| y |
| 2 |
| 1 |
解得y=0.324
SO2----->Na2SO3------>S----->Na2S2O3?5H2O
| 3y |
| 2 |
| 3y |
| 2 |
则m(Na2S2O3?5H2O )=0.324mol×
| 3 |
| 2 |
故答案为:120.5.
点评:本题考查了有关方程式的计算,注意根据原子守恒和方程式计算解答,题目难度中等,侧重于考查学生计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 铁生锈是一种常见的自然现象,其主要的化学反应方程式为:4Fe+3O2+2xH2O═2Fe2O3?xH2O.如图为一放在水槽中的铁架,水位高度如图所示.最容易生锈的铁架横杆是( )
铁生锈是一种常见的自然现象,其主要的化学反应方程式为:4Fe+3O2+2xH2O═2Fe2O3?xH2O.如图为一放在水槽中的铁架,水位高度如图所示.最容易生锈的铁架横杆是( )| A、① | B、② | C、③ | D、④ |
下列有关元素的性质及其递变规律正确的是( )
| A、IA族元素与ⅦA族元素间形成的化合物一定含离子键 |
| B、第二周期元素从左到右,最高正价从+1递增到+7,最低负价从-4升高到-1 |
| C、同主族非金属元素的简单阴离子还原性越强,其气态氢化物的稳定性越弱 |
| D、同周期主族金属元素的化合价越高,其原子失电子能力越强 |
常温下,下列溶液中离子浓度关系表达正确的是( )
| A、Na2CO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-) |
| B、0.1mol?L-1的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| C、向NH4HSO4的水溶液中逐滴滴入NaOH溶液,至中性的溶液中:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-) |
| D、pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
 化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性能.
化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性能. ,芳香烃A能发生如图一系列转化:
,芳香烃A能发生如图一系列转化:
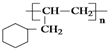 的线路.(用A→…→目标产物 在箭号上写明反应试剂及反应条件.)
的线路.(用A→…→目标产物 在箭号上写明反应试剂及反应条件.) 糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志.长期摄入高热量食品和缺少运动都易导致糖尿病.
糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志.长期摄入高热量食品和缺少运动都易导致糖尿病.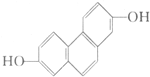 质子核磁共振谱是研究有机化合物结构的有力手段之一.结构中的等效氢原子核磁共振谱中都给出了相应的峰值 (信号),谱中峰的强度与结构中的H原子数成正比.试回答,结构简式为如图所示的有机化合物:
质子核磁共振谱是研究有机化合物结构的有力手段之一.结构中的等效氢原子核磁共振谱中都给出了相应的峰值 (信号),谱中峰的强度与结构中的H原子数成正比.试回答,结构简式为如图所示的有机化合物: