题目内容
10.氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法.(1)利用ClO2氧化氮氧化物反应过程如下:

反应I的方程式是2NO+ClO2+H2O═NO2+HNO3+HCl,该反应的氧化产物为NO2、HNO3,
反应II的化学方程式为2NO2+4Na2SO3═N2+4Na2SO4.
(2)可用甲烷催化还原氮氧化物.已知:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
①已知NO气体会分解为NO2气体和N2气体,写出该反应的热化学方程式4NO(g)═2NO2(g)+N2(g))△H=$\frac{1}{2}$(△H2-△H1).
②现有一份NO与NO2的混合气体,其平均相对分子量为34,用16g甲烷气体催化还原该混合气 体,恰好完全反应生成氮气,二氧化碳气体和水蒸气,共放出热量1042.8kJ.则该混合气体中NO和NO2的物质的量之比为3:1,若已知上述反应△H2=-1160kJ•mol-1,则△H1=-574 kJ/mol.
分析 (1)氧化还原反应中,化合价升高的物质作还原剂,还原剂发生氧化反应,生成的产物为氧化产物;二氧化氮具有氧化性,能氧化Na2SO3生成Na2SO4,本身被还原成氮气;
(2)①根据盖斯定律结合已知方程式构建目标方程式,焓变与化学计量数成正比;
②相同条件下,不同气体的摩尔质量之比等于其密度之比,据此计算氮氧化物平均摩尔质量,再根据平均摩尔质量计算NO和二氧化氮的物质的量之比;
根据盖斯定律确定甲烷和二氧化氮之间的方程式,根据甲烷和NO、NO2之间的反应确定分别和NO、NO2之间反应需要甲烷的物质的量之比,再根据焓变进行计算.
解答 解:(1)反应Ⅰ的化学方程式是2NO+ClO2+H2O═NO2+HNO3+HCl化合价变化为:化合价升高:NO(+2)→NO2(+4)、HNO3(+5),化合价降低:ClO2(+4)→HCl(-1),化合价升高的物质作还原剂,还原剂发生氧化反应,生成的产物为氧化产物,所以:该反应的氧化产物为NO2、HNO3,二氧化氮具有氧化性,能氧化Na2SO3生成Na2SO4,本身被还原成氮气,方程式为2NO2+4Na2SO3═N2+4Na2SO4,
故答案为:NO2、HNO3;2NO2+4Na2SO3═N2+4Na2SO4;
(2)①Ⅰ、CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1
Ⅱ、CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
将(Ⅱ-Ⅰ)×$\frac{1}{2}$得:4NO(g)═2NO2(g)+N2(g))△H=$\frac{1}{2}$(△H2-△H1),
故答案为:4NO(g)═2NO2(g)+N2(g))△H=$\frac{1}{2}$(△H2-△H1);
②NO与NO2的混合气体,其平均相对分子量为34,所以混合气体的摩尔质量为34g/mol,设n(NO)为x,n(NO2)为y,
混合气体摩尔质量=$\frac{30xg+46yg}{(x+y)mol}$=34g/mol,x:y=3:1,
16g甲烷的物质的量=$\frac{16g}{16g/mol}$=1mol,CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
根据盖斯定律知,CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=0.5(△H1+△H2),NO和NO2的物质的量之比为3:1,根据方程式知,当NO和NO2完全转化为氮气时,分别和NO、NO2反应的甲烷的物质的量之比=$\frac{3}{4}$:$\frac{1}{2}$=3:2,则有0.6mol甲烷和NO反应、0.4mol的甲烷和NO2反应,0.6mol甲烷和NO反应放出的热量=0.6mol×1160kJ/mol=696kJ,0.4mol甲烷和NO2完全反应放出的热量=1042.8kJ-696kJ=346.8kJ,则0.4mol甲烷和NO2完全反应放出的热量=0.5(△H1+△H2)×0.4mol=0.2mol×(1160kJ/mol+△H2)=346.8kJ,则△H2=$\frac{346.8kJ}{0.2mol}$=-574 kJ/mol,
故答案为:3:1;-574 kJ/mol.
点评 本题综合考查了反应热的计算,侧重于对基础知识综合应用的考查,注意盖斯定律的熟练应用,题目难度中等.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案| A. | 升高温度,活化分子百分数增大,有效碰撞的几率增大,反应速率增大 | |
| B. | 增大反应物浓度,单位体积内活化分子数增多,有效碰撞的几率增大,反应速率增大 | |
| C. | 具有足够能量的分子相互碰撞就一定能发生化学反应 | |
| D. | 正催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞的几率增大,反应速率增大 |
| A. | 负极:4OH--4e-═O2+2H2O | B. | 负极:H2+2OH--2e-═2H2O | ||
| C. | 正极:O2+4e-═4O2- | D. | 正极:H2-2e-═2H+ |
| A. | 碳酸的电离方程式:H2CO3?2H++CO32- | |
| B. | 硫化钠水解:S2-+2H2O?H2S+2OH- | |
| C. | 往AgI悬浊液中滴加Na2S饱和溶液:2Ag+ (aq)+S2-(aq)=Ag2S(s) | |
| D. | 用醋酸除水垢:2CH3COOH+CaCO3=2CH3COO-+Ca2++H2O+CO2↑ |
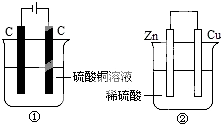 如图两个装置中,分别装有200mL对应的饱和溶液,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,分别装有200mL对应的饱和溶液,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | ②中负极:2H++2e-═H2↑ | |
| D. | 溶液的pH变化:①减小,②增大 |
| A. | 10L | B. | 15L | C. | 20L | D. | 25L |
 2NH3(g)△H=+92.4kJ•mol﹣1,下列说法正确的是( )
2NH3(g)△H=+92.4kJ•mol﹣1,下列说法正确的是( )