题目内容
【题目】酸雨是含硫氧化物或含氮氧化物随雨写降到地面形成的,主要由化石燃料的大量使用造成,酸雨的治理响应了十九大报告提出的保护环境的基本国策。
(1)煤燃烧烟尘中的锰、铁等可使SO2转化为SO3发生反应2SO2(g)+O2(g)=2SO3(g)。某温度下将2.0molSO2和1.0molO2充入2L密闭容器中,若反应达平衡后,SO2的平衡转化率为0.6,则该反应的平衡常数为______。若升高温度,平衡常数减小,则该反应的ΔH_______0(填“>”、“=”“<”)。
(2)高浓度SO2和NO2在浓雾天气下反应生成了两种物质,其中一种为亚硝酸(HNO2),该过程发生反应的化学方程式为_________。
(3)洗涤含SO2的烟气,可以减少SO2排放,以下物质的溶液可作洗涤剂的是______。
a.氨气 b.苏打 c.氨水 d.明矾
(4)汽车尾气中含有NOx和CO,已知气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g),则在恒容密闭容器中,下列说法中能说明该反应达到平衡状态的是________。
2NO(g),则在恒容密闭容器中,下列说法中能说明该反应达到平衡状态的是________。
a.混合气体的压强保持不变
b.混合气体的平均相对分子质量保持不变
c.NO质量分数保持不变
d.氧气的浓度保持不变
e.N2和NO正反应速率之比为1:2
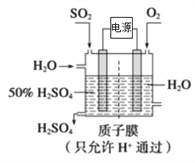
(5)SO2可以变废为宝,利学家研究出了用电化学原理生产硫酸的新工艺(如下图所示),其阳极的电极反应式为__________。
【答案】 11.25 < 2NO2+SO2+2H2O=H2SO4+2HNO2 bc cd SO2-2e-+2H2O=SO42-+4H+
【解析】本题主要考查化学平衡的移动。
(1)各物质的平衡浓度为:c(SO2)=0.4mol/L,c(O2)=0.2mol/L,c(SO3)=0.6mol/L,平衡常数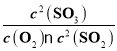 =11.25。若升高温度,平衡常数减小,说明升温平衡左移,则该反应的ΔH<0。
=11.25。若升高温度,平衡常数减小,说明升温平衡左移,则该反应的ΔH<0。
(2)高浓度SO2和NO2在浓雾天气下反应生成了两种物质,其中一种为亚硝酸(HNO2),N的化合价降低,同时,S的化合价升高产生硫酸,该过程发生反应的化学方程式为2NO2+SO2+2H2O=H2SO4+2HNO2。
(3)a. 不发生化学反应,故a不可作洗涤剂;b. 2SO2+Na2CO3+H2O![]() 2NaHSO3+CO2,故b可作洗涤剂;c. NH3+H2O+SO2
2NaHSO3+CO2,故b可作洗涤剂;c. NH3+H2O+SO2![]() NH4HSO3,故c可作洗涤剂;d.不发生化学反应,故d不可作洗涤剂。故选bc。
NH4HSO3,故c可作洗涤剂;d.不发生化学反应,故d不可作洗涤剂。故选bc。
(4)a.该反应气体物质的量不变,混合气体的压强始终保持不变,故a不能说明该反应达到平衡状态;b.混合气体的质量和物质的量不变,混合气体的平均相对分子质量始终保持不变,故b不能说明该反应达到平衡状态;c.NO质量分数随着反应进行而改变,当NO质量分数保持不变时,说明反应达到平衡状态,故c能说明该反应达到平衡状态;d.氧气的浓度随着反应进行而改变,当氧气的浓度保持不变时,说明反应达到平衡状态,故d能说明该反应达到平衡状态。e.不能说明正反应速率等于逆反应速率,故e不能说明该反应达到平衡状态。故选cd。
(5)SO2在阳极被氧化为硫酸,阳极的电极反应式为SO2-2e-+2H2O=SO42-+4H+。

【题目】用中和滴定法测定某盐酸的物质的量浓度。
(1)标准溶液应盛于___________(填“A”或“B”)滴定管中。
(2)若选用酚酞作指示剂,以0.1250 mol·L-1的标准氢氧化钠溶液滴定,如何判断滴定终点____________。
(3)实验数据记录如下表,请分析数据并计算,盐酸的物质的量浓度=_________mol·L-1。

滴定次数 | 待测溶液体积/mL | ||
标准碱液 | |||
滴定前读数/mL | 滴定后读数/mL | ||
1 | 20.00 | 0.00 | 16.02 |
2 | 20.00 | 0.00 | 15.98 |
3 | 20.00 | 0.00 | 16.00 |