题目内容
【题目】已知A、B、C、D、E为原子序数依次增大的五种短周期元素,A与B形成的共价化合物M的水溶液呈碱性,C原子的最内电子数是最外层电子数的2倍,D是同周期中单核离子半径最小的元素,E元素的最高正价与最低负价的代数和为6。请回答下列问题:
(1)化合物M的电子式为_________
(2)B、C所形成的简单离子中,半径较大的是________用离子符号表示)。
(3)E的单质与A的简单氧化物反应的离子方程式为________
(4)A、D形成的化合物DA3与水反应生成无色气体,则该反应的化学方程式为________,每生成1mol气体转移的电子数为_________。
(5)工业上,将CEO3与Na2SO3溶液混合,再加人转H2SO4制备净水剂EO2,则该反应的离子方程式为__________
(6)COA的水溶液和AE溶液反应,生成0.5mol水时放出的热量为28.65kJ,则该反应的热化学方程式为_________
【答案】 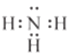 或
或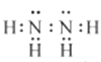 N3- Cl2+H2O=Cl-+HClO+H+ AlH3+3H2O=Al(OH)3+3H2↑ NA (或6.02×1023) 2C1O3-+SO32-+2H+=SO42-+2C1O2↑+H2O NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)ΔH=-57.3KJ/mol
N3- Cl2+H2O=Cl-+HClO+H+ AlH3+3H2O=Al(OH)3+3H2↑ NA (或6.02×1023) 2C1O3-+SO32-+2H+=SO42-+2C1O2↑+H2O NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)ΔH=-57.3KJ/mol
【解析】本题主要考查元素周期表和元素周期律。
已知A、B、C、D、E为原子序数依次增大的五种短周期元素,A与B形成的共价化合物M的水溶液呈碱性,M可以是氨,A、B分别是氢、氮。C原子的最内电子数是最外层电子数的2倍,C是钠。D是同周期中单核离子半径最小的元素,D是铝。E元素的最高正价与最低负价的代数和为6,E是氯。
(1)化合物M的电子式为![]() 或
或 。
。
(2)B、C所形成的简单离子的电子层结构相同,离子半径随着核电荷数增大而减小,所以半径较大的是N3-。
(3)E的单质氯气与A的简单氧化物水反应的离子方程式为Cl2+H2O=Cl-+HClO+H+。
(4)A、D形成的化合物DA3与水反应生成无色气体,则该反应的化学方程式为AlH3+3H2O=Al(OH)3+3H2↑,H2~e-,每生成1mol气体转移的电子数为6.02×1023。
(5)工业上,将CEO3与Na2SO3溶液混合,再加人H2SO4制备净水剂EO2,则该反应的离子方程式为2C1O3-+SO32-+2H+=SO42-+2C1O2↑+H2O。
(6)COA的水溶液和AE溶液反应,生成0.5mol水时放出的热量为28.65kJ,则该反应的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) ΔH=-57.3KJ/mol。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案