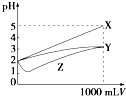
题目内容
【题目】用中和滴定法测定某盐酸的物质的量浓度。
(1)标准溶液应盛于___________(填“A”或“B”)滴定管中。
(2)若选用酚酞作指示剂,以0.1250 mol·L-1的标准氢氧化钠溶液滴定,如何判断滴定终点____________。
(3)实验数据记录如下表,请分析数据并计算,盐酸的物质的量浓度=_________mol·L-1。

滴定次数 | 待测溶液体积/mL | ||
标准碱液 | |||
滴定前读数/mL | 滴定后读数/mL | ||
1 | 20.00 | 0.00 | 16.02 |
2 | 20.00 | 0.00 | 15.98 |
3 | 20.00 | 0.00 | 16.00 |
【答案】 A 当加入最后一滴标准液时,溶液恰好出现红色且半分钟内红色不褪去 0.1000
【解析】试题分析:(1)标准溶液氢氧化钠应盛于碱式滴定管中,A是碱式滴定管,B是酸式滴定管,即盛于A中;
(2)酚酞的变色范围是8.2~10.0,所以若选用酚酞作指示剂,则滴定终点的实验现象是当加入最后一滴标准液时,溶液恰好出现红色且半分钟内红色不褪去;
(3)根据表中数据可知三次实验消耗标准液体积的平均值为16.00mL,所以盐酸的浓度为![]() ="0.100" 0mol/L。
="0.100" 0mol/L。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目