题目内容
【题目】A,B,C,D 4种元素的核电荷数依次增大,它们的离子的电子层数相同且最外层电子数均为8.A原子的L层电子数与K,M层电子数之和相等,D原子的K,L层电子数之和等于电子总数的一半.请回答下列问题:
(1)4种元素的符号依次是A , B , C , D . 它们的原子半径由大到小的顺序是 .
(2)试写出4种元素的离子结构示意图:A , B , C , D . 它们离子的半径由大到小的顺序 .
(3)它们最高价氧化物对应水化物的化学式分别是 , 分别比较它们酸性和碱性的强弱 .
(4)写出能够生成的气态氢化物的化学式: , 比较其稳定性: , 理由是 .
【答案】
(1)S;Cl;K;Ca;K>Ca>S>Cl
(2)![]() ;
;![]() ;
; ;
; ;r(S2﹣)>r(Cl﹣)>r(K+)>r(Ca2+)
;r(S2﹣)>r(Cl﹣)>r(K+)>r(Ca2+)
(3)H2SO4、HClO4、KOH、Ca(OH)2;酸性:HClO4>H2SO4 , 碱性:KOH>Ca(OH)2
(4)HCl、H2S;HCl;氯元素的非金属性强于硫元素
【解析】解:A、B、C、D 4种元素的核电荷数依次增大,A原子的L层电子数与K、M层电子数之和相等,则M层电子数=8﹣2=6,故A为S元素;D原子的K、L层电子数之和等于电子总数的一半,则L层已经排满电子,故核外电子数=2×(2+8)=20,故D为Ca元素,四元素的离子的电子层数相同且最外层电子数均为8,结合原子序数,可推知,B为Cl、C为K.
(1.)由上述分析可知,A为S,B为Cl,C为K,D为Ca,同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:K>Ca>S>Cl,所以答案是:S;Cl;K;Ca;K>Ca>S>Cl;
(2.)S2﹣离子结构示意图为 ![]() ,Cl﹣离子结构示意图为
,Cl﹣离子结构示意图为 ![]() ,K+离子结构示意图为
,K+离子结构示意图为  ,Ca2+离子结构示意图为
,Ca2+离子结构示意图为  ,电子层结构相同,核电荷数越大,离子半径越小,故离子半径r(S2﹣)>r(Cl﹣)>r(K+)>r(Ca2+),所以答案是:
,电子层结构相同,核电荷数越大,离子半径越小,故离子半径r(S2﹣)>r(Cl﹣)>r(K+)>r(Ca2+),所以答案是: ![]() ;
; ![]() ;
;  ;
;  ;r(S2﹣)>r(Cl﹣)>r(K+)>r(Ca2+);
;r(S2﹣)>r(Cl﹣)>r(K+)>r(Ca2+);
(3.)A、B、C、D 4种元素的最高价氧化物对应水化物的化学式分别是H2SO4、HClO4、KOH、Ca(OH)2 , 非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2SO4 , 金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:KOH>Ca(OH)2 , 所以答案是:H2SO4、HClO4、KOH、Ca(OH)2;酸性:HClO4>H2SO4 , 碱性:KOH>Ca(OH)2;
(4.)生成的气体氢化物有HCl、H2S,氯元素的非金属性强于硫元素,故氢化物稳定性HCl>H2S,所以答案是:HCl、H2S;HCl;氯元素的非金属性强于硫元素.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】已知有机物A、C、D、F具有下列性质:
物质 | 性质 |
A | 属于酯类化合物 |
C | 含有4类氢原子 |
D | 只含有一个氧原子,与Na反应放出H2 |
F | 属于烃 |
转化关系如图所示:
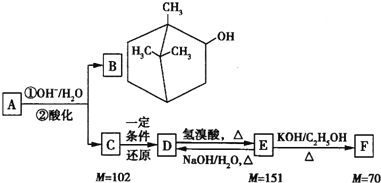
请回答下列问题:
(1)B的分子式为 ____________。
(2)B不能发生的反应是 (_______)(填序号)。
a.氧化反应 b.聚合反应 c.消去反应 d.取代反应 e.与Br2加成反应
(3)写出D→E、E→F的反应:
D→E ____________________________ ;
E→F______________________________。