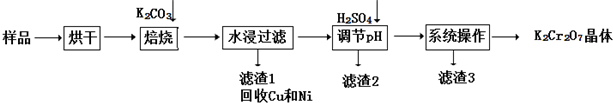
题目内容
10.室温下,下列溶液的离子浓度关系正确的是( )| A. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合c(Na+)+c(H+)=c(OH-)+c( HC2O4-) | |
| B. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| C. | NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) | |
| D. | pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
分析 A.根据混合液中的电荷守恒判断;
B.氢氧根离子来自水的电离和硫离子水解,则c(OH-)>c(HS-);
C.根据硫酸氢钠溶液中的物料守恒和电荷守恒判断;
D.pH=12的氨水与pH=2的盐酸中,氨水浓度大于盐酸,等体积混合,氨水过量,溶液呈碱性.
解答 解:A.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合,根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+2c(C2O42-)+c(HC2O4- ),故A错误;
B.Na2S溶液中,硫离子部分水解,溶液呈碱性,由于氢氧根离子来自水的电离和硫离子水解,则c(OH-)>c(HS-),溶液中正确的离子浓度大小为:c(Na+)>c(OH-)>c(HS-)>c(H2S),故B错误;
C.NaHSO4溶液中,根据电荷守恒可知:c(H+)+c(Na+)=2c(SO42-)+c(OH-),根据物料守恒c(Na+)=c(SO42-)可知c(H+)=c(SO42-)+c(OH-),故C正确;
D.pH=12的氨水与pH=2的盐酸中,氨水浓度大于盐酸,等体积混合,氨水过量,溶液呈碱性,所以c(OH-)>c(H+),溶液中存在电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-),所以得c(NH4+)>c(Cl-),溶液中一水合氨电离程度较小,所以c(Cl-)>c(OH-),则溶液中离子浓度大小顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.为纪念诺贝尔,人们把第102号元素命名为锘,关于${\;}_{102}^{254}$No原子下列说法正确的是( )
| A. | 质子数是254 | B. | 质量数是102 | C. | 中子数是152 | D. | 电子数是254 |
18.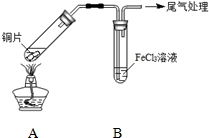 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验.
FeCl3溶液显酸性的原因是Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3+3H+.写出装置A中产生SO2的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象.将混合液放置12小时,溶液才变成浅绿色.
【查阅资料】Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+.生成Fe(HSO3)2+离子的反应为可逆反应.
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:H2O+SO2=H2SO3、H2SO3$\stackrel{△}{?}$H++HSO3-、Fe3++HSO3-$\stackrel{△}{?}$Fe(HSO3)2+.
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验.
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为生成蓝色沉淀.
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验.
| 步骤① | 配制1mol•L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A. |
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象.将混合液放置12小时,溶液才变成浅绿色.
【查阅资料】Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+.生成Fe(HSO3)2+离子的反应为可逆反应.
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:H2O+SO2=H2SO3、H2SO3$\stackrel{△}{?}$H++HSO3-、Fe3++HSO3-$\stackrel{△}{?}$Fe(HSO3)2+.
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验.
| 步骤② | 往5mL 1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
5.用化学方法不能实现的是( )
| A. | 生成一种新分子 | B. | 生成一种新离子 | ||
| C. | 生成一种新同位素 | D. | 生成一种新单质 |
15.下列有关金属及其化合物的说法正确的是( )
| A. | MgO和Al2O3均只能与酸反应,不能与碱反应 | |
| B. | Na和Fe在一定条件下与水反应都生成H2和对应的碱 | |
| C. | Mg和Al都可以用电解法冶炼得到 | |
| D. | Na2O和Na2O2与CO2反应产物相同 |
20.下列说法中,正确的是( )
| A. | 在任何条件下,纯水的pH都等于7 | |
| B. | 在任何条件下,纯水都呈中性 | |
| C. | 在95℃时,纯水的 pH小于7,显酸性 | |
| D. | 在95℃时,纯水中的[H+]小于10-7mol•L-1 |

 、G
、G .
. .
.