题目内容
17.20世纪70年代以后,由于对氢能源的研究和开发日趋重要,首先要解决氢气的安全贮存和运输问题.储氢材料和储氢技术是关键技术,是大家关注的热点之一,储氢材料范围由金属扩展至合金甚至有机物领域.根据信息材料请问答以下问题:(1)金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
I.2Li+H2$\frac{\underline{\;\;△\;\;}}{\;}$2LiH
Ⅱ.LiH+H2O═LiOH+H2↑
已知LiH固体密度为0.8g/cm3.用锂吸收11.2L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为1:1120.
(2)NaBH4(氢元素为-1价)也是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为NaBH4+2H2O=NaBO2+4H2↑.
分析 (1)计算氢气物质的量,结合方程式计算生成LiH的物质的量,再计算LiH的质量,结合密度计算LiH的体积;
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,还生成氢气,且反应前后B的化合价不变,可知H元素化合价由-1价、+1价变为0价,再结合转移电子守恒书写化学方程式.
解答 解:(1)标况下11.2L 氢气物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,由2Li+H2$\frac{\underline{\;\;△\;\;}}{\;}$2LiH,可知生成LiH为1mol,故LiH的质量为1mol×8g/mol=8g,故其体积为$\frac{8g}{0.8g/mL}$=10mL=0.01L,生成的LiH体积与被吸收的H2体积比为0.01L:11.2L=1:1120,
故答案为:1:1120;
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,还生成氢气,且反应前后B的化合价不变,所以NaBH4与H2O中H元素发生归中反应,H元素化合价由-1价、+1价变为0价,依据得失电子守恒可知:NaBH4的系数为1,H2O的系数为2,依据原子个数守恒配平反应方程式:NaBH4+2H2O=NaBO2+4H2↑,
故答案为:NaBH4+2H2O=NaBO2+4H2↑.
点评 本题考查化学方程式有关计算、陌生方程式的书写、信息获取与迁移运用,关键是对储氢载体中吸氢和放氢过程的理解.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案
相关题目
5.下列化学用语正确的是( )
| A. | CO2的电子式: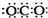 | B. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | ||
| C. | 甲烷的结构简式:CH4 | D. | 乙烯分子的球棍模型: |
12.下列物质在一定条件下能发生水解反应,且水解产物能发生银镜反应的是( )
| A. | 葡萄糖 | B. | 淀粉 | C. | 蔗糖 | D. | 乙酸乙酯 |
2.某烷烃相对分子质量为86,与氯气反应生成的一氯代物只有两种,其结构简式是( )
| A. | CH3(CH2)4CH3 | B. | C2H5C(CH3)3 | C. | (C2H5)2CHCH3 | D. | (CH3)2CHCH3 |
12.关于σ键和π键的比较,下列说法不正确的是( )
| A. | σ键是轴对称的,π键是镜像对称的 | |
| B. | σ键是“头碰头”式重叠,π键是“肩并肩”式重叠 | |
| C. | σ键不能断裂,π键容易断裂 | |
| D. | H原子只能形成σ键,O原子可以形成σ键和π键 |
13.常温常压下为无色液体,而且密度大于水的是( )
①苯
②硝基苯③溴苯
④四氯化碳⑤溴乙烷
⑥乙酸乙酯.
①苯
②硝基苯③溴苯
④四氯化碳⑤溴乙烷
⑥乙酸乙酯.
| A. | ①⑥ | B. | ②③④ | C. | ②③④⑤ | D. | ③④⑤⑥ |
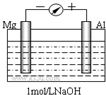 实验是化学的最高法庭.以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极.某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
实验是化学的最高法庭.以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极.某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
 .
.