题目内容
4.用98%浓H2SO4(密度为1.84g/cm3)配成1:5的H2SO4溶液(密度为1.19g/cm3).(1)求所得H2SO4溶液中溶质的质量分数;
(2)如果用所得稀H2SO4来配制0.1mol/L的H2SO4溶液500mL,问应该怎样配制?
分析 (1)m=ρV、w%=$\frac{溶质质量}{溶液质量}$,设98%浓H2SO4的体积为V,1:5的H2SO4溶液质量分数为$\frac{1.84V}{1.84V+5V}$×100%;
(2)配制0.1m01/L的H2SO4溶液500mL,配制前后溶质的物质的量不变,在烧杯中稀释、冷却后转移到500mL容量瓶中定容.
解答 解:(1)设98%浓H2SO4的体积为V,1:5的H2SO4溶液质量分数为$\frac{1.84V}{1.84V+5V}$×100%=26.9%,
答:所得H2SO4溶液中溶质的质量分数为26.9%;
(2)配制前后溶质的物质的量不变,则需要所得溶液的体积为V=$\frac{0.5L×0.1mol/L}{\frac{1000×1.19×26.9%}{98}}$=0.0153L=15.3mL,用量筒量取后在烧杯中稀释、冷却后,转移到500mL容量瓶中定容、摇匀得到0.1mol/L的H2SO4溶液,
答:用量筒量取15.3mL所得稀硫酸在烧杯中稀释、冷却后,转移到500mL容量瓶中定容、摇匀得到0.1mol/L的H2SO4溶液.
点评 本题考查物质的量浓度的计算及溶液配制,为高频考点,把握物质的量浓度计算公式、溶液配制的方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
14.某主族元素原子R的第五电子层上只有一个电子.下列描述正确的是( )
| A. | 其单质在常温下跟水的反应不如钠剧烈 | |
| B. | 其原子半径比钾离子半径小 | |
| C. | In是第5周期ⅠB族元素 | |
| D. | 其氢氧化物能使氢氧化铝溶解 |
15.海水中含有氯化镁,是镁的主要来源之一.从海水中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳;
②在引有海水的水渠中加入石灰乳、沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤、干燥产物;
④将得到的产物熔融后电解.
关于提取镁,下列说法正确的是( )
①把贝壳制成石灰乳;
②在引有海水的水渠中加入石灰乳、沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤、干燥产物;
④将得到的产物熔融后电解.
关于提取镁,下列说法正确的是( )
| A. | 此法对环境不会造成任何污染 | |
| B. | 沉降、过滤、洗涤沉淀物操作中既有物理变化也有化学变化 | |
| C. | 若提取12 kg Mg,则电子转移1 000 mol | |
| D. | 以上提取镁的过程涉及的离子反应共有3个 |
12.BF3与一定量水形成(H2O)2•BF3晶体Q,Q在一定条件下可转化为R:
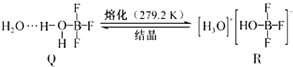
晶体Q中各种微粒间的作用力不涉及( )

晶体Q中各种微粒间的作用力不涉及( )
| A. | 离子键 | B. | 共价键 | C. | 配位键 | D. | 氢键 |
19.常春藤皂苷元有刺激黏膜的作用,其结构简式如图.常春藤皂苷元中官能团种类有( )


| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
9.下列溶液中物质的量浓度为1mol•L-1的是( )
| A. | 将40g NaOH溶解在1L 水中 | |
| B. | 将22.4LHCl气体溶于水配成1L溶液 | |
| C. | 将1 L10mol•L-1的浓盐酸加入9L水中 | |
| D. | 将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL |
16.下列有关说法正确的是( )
| A. | 主族元素都属于非金属元素 | |
| B. | 氧元素的相对原子质量为16 | |
| C. | 12C可用于测定古代出土文物的年代 | |
| D. | 氯气通入KI-淀粉溶液中会变蓝 |
15.已知如表均为烷烃分子的化学式,且它们的一氯取代物只有一种,
则第6项烷烃分子的化学式为( )
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4 | C2H6 | C5H12 | C8H18 | C17H36 | … | … |
| A. | C26H54 | B. | C27H56 | C. | C53H108 | D. | C54H110 |
16.下列关于实验现象的描述正确的是( )
| A. | 铜锌组成的原电池中,电流从锌经过导线流向铜 | |
| B. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面发生氧化反应,出现大量气泡 | |
| C. | 把铁片插入氯化铜溶液中,在铁片表面出现一层铜 | |
| D. | 把锌片放入盐酸中制氢气,可向其中加入几滴硝酸或硝酸铜溶液以加快反应速率 |