题目内容
15.海水中含有氯化镁,是镁的主要来源之一.从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;
②在引有海水的水渠中加入石灰乳、沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤、干燥产物;
④将得到的产物熔融后电解.
关于提取镁,下列说法正确的是( )
| A. | 此法对环境不会造成任何污染 | |
| B. | 沉降、过滤、洗涤沉淀物操作中既有物理变化也有化学变化 | |
| C. | 若提取12 kg Mg,则电子转移1 000 mol | |
| D. | 以上提取镁的过程涉及的离子反应共有3个 |
分析 ①把贝壳制成石灰乳[Ca(OH)2],发生的反应为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、CaO+H2O=Ca(OH)2;
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物,发生的反应为Mg2++2OH-=Mg(OH)2↓;
③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物,发生的反应为Mg(OH)2+2HCl=MgCl2+2H2O;
④将得到的产物熔融电解得到镁,发生的反应为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
A.电解熔融氯化镁生成污染性气体氯气;
B.沉降、过滤、洗涤沉淀物是生成的氢氧化镁和沉淀分离;
C.质量换算成物质的量n=$\frac{m}{M}$,依据Mg2+~Mg~2e-计算电子转移;
D.海水提镁过程中氧化钙生成氢氧化钙、镁离子沉淀、氢氧化镁溶解、氯化镁熔融电解都是离子反应;
解答 解:A.④将得到的产物熔融电解得到镁,发生的反应为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,反应过程中生成的氯气是有毒气体,污染环境,故A错误;
B.沉降是沉淀镁离子属于化学变化,过滤、洗涤沉淀物对生成的氢氧化镁沉淀的提纯分离过程,属于物理变化过程,故B正确;
C.若提取12 kg Mg物质的量=$\frac{12000g}{24g/mol}$=500mol,依据Mg2+~Mg~2e-,则电子转移1 000 mol,故C正确;
D.提取镁的过程涉及的离子反应有,生成石灰乳CaO+H2O=Ca(OH)2,沉淀镁离子反应为Mg2++2OH-=Mg(OH)2↓,沉淀溶解反应为Mg(OH)2+2HCl=MgCl2+2H2O,熔融电解得到镁MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.故D错误;
故选BC..
点评 本题考查了海水资源的利用,涉及镁的提取,知道每一步发生的反应、操作目的是解本题关键,知道金属冶炼方法与其活泼性强弱的关系,题目难度不大.

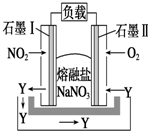 熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,下列有关说法正确的是( )
熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,下列有关说法正确的是( )| A. | 石墨Ⅰ极为正极,石墨Ⅱ极为负极 | |
| B. | Y的化学式可能为NO | |
| C. | 石墨Ⅰ极的电极反应式为NO2+NO${\;}_{3}^{-}$-e-═N2O5 | |
| D. | 石墨Ⅱ极上发生氧化反应 |
| 装置 |  |  |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙,若电路中转移6.02×1022个e-,则C上增加的质量为3.2g.
(3)装置丙中溶液的pH变大(填“变大”“变小”或“不变”).
(4)四种金属活动性由强到弱的顺序是D>A>B>C.
| A. | 乙醇是一种可再生能源 | |
| B. | 乙醇只能在实验室内做燃料 | |
| C. | 乙醇易燃烧,污染小 | |
| D. | 目前,粮食作物是制乙醇的重要原料 |
| A. | $\frac{y-2x}{a}$ mol•L-1 | B. | $\frac{y-x}{a}$ mol•L-1 | C. | $\frac{2y-2x}{a}$ mol•L-1 | D. | $\frac{2y-4x}{a}$ mol•L-1 |
| A. | CH3CHBrCH3 | B. | CH3CH2CBr( CH3)2 | C. |  | D. | CH3Cl |