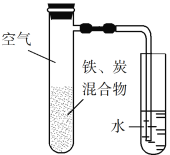
题目内容
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池具有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,电池总反应为M1-xFexPO4+LiC6![]() LiM1-xFexPO4+6C,其原理如图所示,下列说法正确的是( )
LiM1-xFexPO4+6C,其原理如图所示,下列说法正确的是( )
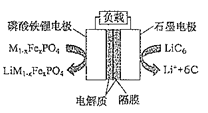
A.充电时,正极质量增加
B.放电时,电流由石墨电极流向磷酸铁锂电极
C.充电时,阴极反应式为Li++6C+e-═LiC6
D.放电时,Li+移向石墨电极
【答案】C
【解析】
A.充电时,正极发生的反应为LiM1-xFexPO4-e-=M1-xFexPO4+Li+,则正极的质量减小,故A错误;
B.放电时,石墨电极为负极,电流由磷酸铁锂电极流向石墨电极,故B错误;
C.充电时,阴极上锂离子得电子,则阴极反应式为Li++6C+e-═LiC6,故C正确;
D.放电时,阳离子向正极移动,石墨电极为负极,则Li+移向磷酸铁锂电极,故D错误;
故选:C。

【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程为:________________。
(2)今有如下两个热化学方程式:则a_________b(填“>”、“=”或“<”)
2H2(g)+O2(g)=2H2O(g)△H1=a kJmol﹣1
2H2(g)+O2(g)=2H2O(l)△H2=b kJmol﹣1
(3)已知反应N2(g)+3H2(g)═2NH3(g)△H=a kJmol﹣1.试根据表中所列键能数据估算a 的值:________________________(注明“+”或“﹣”)。
化学键 | H﹣H | N﹣H | N≡N |
键能/kJmol﹣1 | 436 | 391 | 945 |
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g)△H=﹣90.8kJmol﹣1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=﹣23.5kJmol﹣1
③CO(g)+H2O(g)═CO2(g)+H2(g)△H=﹣41.3kJmol﹣1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g)的△H=_________.
(5)已知H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kJ·mol-1。
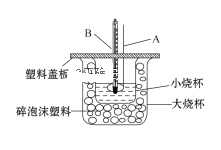
①仪器A的名称___________________;碎泡沫塑料的作用是___________________。
②仪器A不能用铜质搅拌棒代替,其原因是________________________。
③若通过实验测定中和热的ΔH的绝对值常常小于57.3 kJ/mol,其原因可能是_______
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
【题目】中科院大连化学物理研究所的一项最新成果实现了甲烷高效生产乙烯。甲烷在催化作用下脱氢,在不同温度下分别形成CH3、![]() 等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)。
等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)。
物质 | 燃烧热(kJmol-1) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.0 |
(1)已知相关物质的燃烧热如表所示,写出甲烷制备乙烯的热化学方程式______。
(2)现代石油化工采用Ag作催化剂,可实现乙烯与氧气制备X(分子式为C2H4O,不含双键)。该反应符合最理想的原子经济,则反应产物是______(填结构简式)。
(3)在一定条件下,向2L的恒容密闭反应器中充入1molCH4,发生上述(1)反应,10分钟后达到平衡,测得平衡混合气体中C2H4的体积分数为20.0%.则:
①用CH4表示该反应的平均速率为______。
②在该温度下,其平衡常数K=______。
③下列说法正确的是______。
a.升高温度有利于提高C2H4的产率
b.向平衡体系中充入少量He,CH4的转化率降低
c.当混合气体的密度不再变化时,说明该反应达到平衡状态
d.向上述平衡体系中再充入1molCH4,达到平衡后H2的体积分数减小
e.若实验测得:v(正)=k(正)c2(CH4),v(逆)=k(逆)c2(H2)c(C2H4)。其中k(正)、k(逆)为受温度影响的速率常数,该反应的平衡常数K=![]()
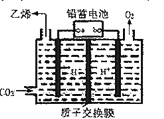
(4)以铅蓄电池为电源,将CO2转化为乙烯的装置如图所示,电解所用电极材料均为惰性电极。电解过程中,阳极区溶液中c(H+)逐渐______(填“增大”、“减小”或“不变”),阴极反应式______。
【题目】某混合溶液中,可能大量含有的离子如下表:
阳离子 | H+、K+、Al3+、NH |
阴离子 | OH-、SO42—、CO32—、AlO2— |
将Na2O2逐渐加入上述混合溶液中并微热,产生沉淀和气体如图所示。

下列说法不正确的是:
A. 上述混合溶液中一定大量含有H+、NH4+、Al3+、Mg2+、SO42—
B. 图中a=4
C. b=7;c=9
D. 此溶液还需要用焰色反应继续检验,才能确定溶液准确组成