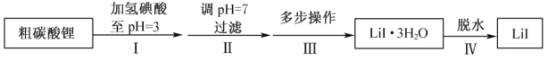
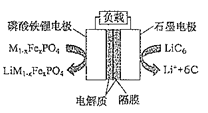
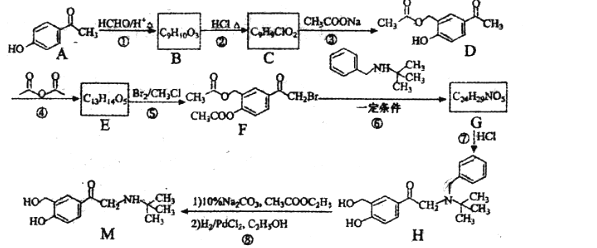
题目内容
【题目】中科院大连化学物理研究所的一项最新成果实现了甲烷高效生产乙烯。甲烷在催化作用下脱氢,在不同温度下分别形成CH3、![]() 等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)。
等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)。
物质 | 燃烧热(kJmol-1) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.0 |
(1)已知相关物质的燃烧热如表所示,写出甲烷制备乙烯的热化学方程式______。
(2)现代石油化工采用Ag作催化剂,可实现乙烯与氧气制备X(分子式为C2H4O,不含双键)。该反应符合最理想的原子经济,则反应产物是______(填结构简式)。
(3)在一定条件下,向2L的恒容密闭反应器中充入1molCH4,发生上述(1)反应,10分钟后达到平衡,测得平衡混合气体中C2H4的体积分数为20.0%.则:
①用CH4表示该反应的平均速率为______。
②在该温度下,其平衡常数K=______。
③下列说法正确的是______。
a.升高温度有利于提高C2H4的产率
b.向平衡体系中充入少量He,CH4的转化率降低
c.当混合气体的密度不再变化时,说明该反应达到平衡状态
d.向上述平衡体系中再充入1molCH4,达到平衡后H2的体积分数减小
e.若实验测得:v(正)=k(正)c2(CH4),v(逆)=k(逆)c2(H2)c(C2H4)。其中k(正)、k(逆)为受温度影响的速率常数,该反应的平衡常数K=![]()
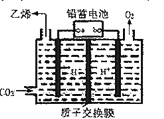
(4)以铅蓄电池为电源,将CO2转化为乙烯的装置如图所示,电解所用电极材料均为惰性电极。电解过程中,阳极区溶液中c(H+)逐渐______(填“增大”、“减小”或“不变”),阴极反应式______。
【答案】2CH4(g)═C2H4(g)+2H2(g) △H=+202.0kJ/mol ![]() 0.025mol·L-1·min-1 0.125 ae 增大 2CO2+12H++12e-=C2H4+4H2O
0.025mol·L-1·min-1 0.125 ae 增大 2CO2+12H++12e-=C2H4+4H2O
【解析】
(1)已知:①H2(g)+1/2O2(g)═H2O(l) △H1=285.8kJ/mol,
②CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H2=890.3kJ/mol,
③C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H3=1411.0kJ/mol,
甲烷制备乙烯的化学方程式为:2CH4(g)═C2H4(g)+2H2(g),反应可由②×2③①×2得到,根据盖斯定律,反应的焓变为△H=2△H2△H32△H1=+202.0kJ/mol,故答案为:2CH4(g)═C2H4(g)+2H2(g) △H=+202.0 kJ/mol;
(2)用Ag作催化剂,可实现乙烯与氧气制备X(分子式C2H4O,不含双键),该反应符合最理想的原子经济,X为![]() ,方程式为
,方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)设平衡时生成的C2H4的物质的量为a,根据三段式:

![]() ×100%=20.0%,a=0.25mol。
×100%=20.0%,a=0.25mol。
①用CH4表示该反应的平均速率为:v(CH4)= =0.025mol·L-1·min-1,故答案为:0.025mol·L-1·min-1;
=0.025mol·L-1·min-1,故答案为:0.025mol·L-1·min-1;
②在该温度下,其平衡常数K= =
=![]() =0.125,故答案为:0.125
=0.125,故答案为:0.125
③a.2CH4(g)═C2H4(g)+2H2(g) △H=+202.0 kJ/mol,正反应为吸热反应,所以升高温度,平衡正向移动,有利于提高C2H4的产率,a正确;
b.恒容密闭反应器中,充入少量He,压强变大,但各物质的浓度不变,平衡不移动,CH4的转化率不变,b错误
c.总质量不变,总体积不变,密度也不变,当混合气体的密度不再变化时,不能说明该反应达到平衡状态,c错误;
d.向上述平衡体系中再充入1molCH4,建立等效平衡,达到平衡后H2的体积分数不变,d错误;
e. v(正)=k(正)c2(CH4),v(逆)=k(逆)c2(H2)·c(C2H4),该反应的平衡常K= =
=![]() ,e正确;故答案为:ae;
,e正确;故答案为:ae;
(4)阴极反应式:2CO2+12H++12e-=C2H4+4H2O,阳极反应式:2H2O-4e-=4 H++O

 阅读快车系列答案
阅读快车系列答案【题目】现有如下实验方案中,可以达到相应实验目的的是
A | B | C | D | |
方 案 |
|
|
|
|
目 的 | 验证不同催化剂对化学反应速率的影响 | 分离乙醇和水 | 将锌板换成铜板 对钢闸门保护效果更好 | 已知:Na2SiO3 + CO2 + H2O == Na2CO3 + H2SiO3↓ 验证非金属性:C > Si |
A. A B. B C. C D. D