题目内容
3.草酸是一种二元弱酸,可用作还原剂、络合剂、掩蔽剂、沉淀剂.某校课外小组的同学设计利用C2H2气体制取H2C2O4•2H2O.回答下列问题:
(1)甲组的同学利用电石(主要成分CaC2,少量CaS及Ca3P2等)并用图1装置制取C2H2[反应原理为:CaC2+2H2O→Ca(OH)2+C2H2(g)△H<0,反应剧烈]:

①装置A用饱和食盐水代替水并缓慢滴入烧瓶中,其目的是减慢反应速率,平缓地产生乙炔.
②装置B中,NaClO将H2S、PH3氧化为硫酸及磷酸,本身还原为NaCl,其中H2S被氧化的离子方程式为H2S+4ClO-=SO42-+4Cl-+2H+.
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化乙炔制取H2C2O4•2H2O.制备装置如图2:
①装置D多孔球泡的作用是增大乙炔气体与硝酸的接触面,充分反应;装置E的作用是防止倒吸.
②D中生成H2C2O4的化学方程式为C2H2+8HNO3$\frac{\underline{\;Hg(NO_{3})_{2}\;}}{20-70℃}$H2C2O4+8NO2+4H2O.
③从装置D得到产品,还需经过浓缩结晶、过滤(填操作名称)洗涤及干燥.
(3)丙组设计了测定乙组产品在H2C2O4•2H2O的质量分数实验.他们的实验步骤如下:精确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,在加入少量稀硫酸,然后用cmol/L酸性KMnO4标准溶液进入滴定,滴至溶液显微红色;共消耗标准溶液VmL.
①滴定时,KMnO4标准溶液盛放在酸式滴定管中(填“酸式”或“碱式”).
②滴定时KMnO4被还原Mn2+,其反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,滴定过程中发现褪色速率先慢后逐渐加快,其主要原因是生成的Mn2+是该反应的催化剂.
③产品中H2C2O4•2H2O的质量分数为$\frac{0.315cV}{m}×100%$(列出含m、c、v的表达式).
分析 (1)①碳化钙和水反应十分剧烈,如果用纯水十分不容易控制反应速度;
②装置B用NaClO将H2S氧化为硫酸,C硫元素化合价升高,则氯元素化合价降低,生成氯离子;
(2)D中,Hg(NO3)2作催化剂,浓硝酸氧化乙炔制取H2C2O4•2H2O,反应为:C2H2+8HNO3$\frac{\underline{\;Hg(NO_{3})_{2}\;}}{△}$ H2C2O4+8NO2+4H2O,多孔球泡增大乙炔气体与硝酸的接触面,充分反应,E装置防止倒吸,F装置吸收生成的二氧化氮气体,将反应后的D浓缩结晶、过滤、洗涤、干燥得产品,据此分析解答;
(3)①根据高锰酸钾的氧化性分析;
②H2C2O4•与KMnO4反应生成锰离子和二氧化碳;锰离子催化反应速率加快;
③根据2MnO4-~5H2C2O4,由高锰酸钾的消耗可得H2C2O4的量,据此计算H2C2O4•2H2O的质量分数.
解答 解:(1)①电石与水反应非常剧烈,为了减慢反应速率,平缓地产生乙炔可用饱和食盐水代替水反应;
故答案为:减慢反应速率,平缓地产生乙炔;
②NaClO将H2S氧化为硫酸,离子反应为:H2S+4ClO-=SO42-+4Cl-+2H+;
故答案为:H2S+4ClO-=SO42-+4Cl-+2H+;
(2)①装置D多孔球泡的作用是增大乙炔气体与硝酸的接触面,充分反应,装置E防止倒吸;
故答案为:增大乙炔气体与硝酸的接触面,充分反应;防止倒吸;
②根据装置图,D中,Hg(NO3)2作催化剂,浓硝酸氧化乙炔反应生成H2C2O4和二氧化氮,反应为:C2H2+8HNO3$\frac{\underline{\;Hg(NO_{3})_{2}\;}}{20-70℃}$H2C2O4+8NO2+4H2O;
故答案为:C2H2+8HNO3$\frac{\underline{\;Hg(NO_{3})_{2}\;}}{20-70℃}$H2C2O4+8NO2+4H2O;
③将反应后的D浓缩结晶、过滤、洗涤、干燥得产品;
故答案为:过滤;
(3)①高锰酸钾具有强氧化性,能氧化橡胶管,故盛放在酸式滴定管中;
故答案为:酸式;
②H2C2O4与KMnO4反应生成锰离子和二氧化碳,离子反应为:2MnO4++5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;生成的Mn2+是该反应的催化剂,故滴定过程中发现褪色速率先慢后逐渐加快;
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;生成的Mn2+是该反应的催化剂;
③根据2MnO4-~5H2C2O4,则n(H2C2O4•2H2O)=n(H2C2O4)=$\frac{5}{2}$×n(MnO4-)=$\frac{5}{2}$×cV×10-3mol,产品中H2C2O4•2H2O的质量分数为$\frac{\frac{5}{2}×cV×1{0}^{-3}×126}{m}×100%$=$\frac{0.315cV}{m}×100%$;
故答案为:$\frac{0.315cV}{m}×100%$.
点评 本题本题考查了物质制备方案设计,主要考查了化学方程式的书写、实验方案评价、氧化还原反应滴定等,题目难度中等,侧重于考查学生的分析问题和解决问题的能量,注意相关基础知识的学习与积累.

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案| A. | 分子的结构是由键角决定的 | |
| B. | 共价键的键能越大,共价键越牢固,由该键形成的分子越稳定 | |
| C. | CF4、CCl4、CBr4、CI4中C-X键的键长、键角均相等 | |
| D. | H2O分子中的共价键比HF分子中的共价键牢固 |
 298K时,在20.0ml0.10mol/L氨水中滴入0.10mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol/L氨水的电离度为1.32%,下列有关叙述不正确的是( )
298K时,在20.0ml0.10mol/L氨水中滴入0.10mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol/L氨水的电离度为1.32%,下列有关叙述不正确的是( )| A. | 该滴定过程应该选择甲基橙作为指示剂 | |
| B. | M点对应的盐酸体积为20.0 mL | |
| C. | M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-) | |
| D. | N点处的溶液中pH<13 |
| A. | 蛋白质和油脂一定条件下都能水解 | |
| B. | 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 | |
| C. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 | |
| D. | 与有机物 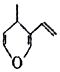 互为同分异构体,且能与NaOH溶液反应的化合物有7种 互为同分异构体,且能与NaOH溶液反应的化合物有7种 |

| A. | 铜电极应与Y电极相连接 | |
| B. | H十透过质子交换膜由左向右移动 | |
| C. | 当N电极消耗0.25mol气体时,则铁电极增重16g | |
| D. | M电极反应式为:CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+ |
 氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2•H2O也是一元弱碱,25℃时电离常数Kb=4.0×10-5.现用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示.下列说法正确的是( )
氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2•H2O也是一元弱碱,25℃时电离常数Kb=4.0×10-5.现用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示.下列说法正确的是( )| A. | 甲胺在水中的电离方程式为:CH3NH2•H2O═CH3NH3++OH- | |
| B. | A、B、C三点溶液中,水电离出来的c(H+):B>C>A | |
| C. | C点所在溶液中$\frac{c(C{H}_{3}N{H}_{2}•{H}_{2}O)}{c(C{H}_{3}N{H}_{3}^{+})}$=2.5×10-5 | |
| D. | B点溶液中存在c(CH3NH2•H2O)>c(CH3NH3+)>c(H+)>c(OH-) |

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是Na2CO3和NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则NH4Cl的浓度最好控制为10 g•L-1.

(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4•2H2O).草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体.草酸镍晶体受热分解的化学方程式为2NiC2O4•2H2O$\frac{\underline{\;高温\;}}{\;}$Ni2O3+3CO↑+CO2↑+4H2O.
 已知:pKa=-lgKa,25℃时,H2SeO3的 pKa1=1.34,pKa2=7.34.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SeO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2SeO3的 pKa1=1.34,pKa2=7.34.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SeO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )| A. | a点所得溶液中:2c(H2SeO3)+c(SeO32-)<0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SeO3)+c(H+)=c(SeO32-)+c(OH-) | |
| C. | c点所得溶液中:c(Na+)<3c(HSeO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SeO32-)>c(HSeO3-) |
