题目内容
下列各组离子在指定溶液中可能大量共存的是( )
| A、通入足量SO2的溶液中:Fe2+、Na+、SO42-、ClO- |
| B、常温下,c(H+)=10-3mol/L的溶液中:Na+、Fe3+、HCO3-、K+ |
| C、水电离出的c(OH-)=10-13mol/L的溶液中:Ba2+、Cl-、NO3-、I- |
| D、遇酚酞显红色的溶液中:AlO2-、HCO3-、K+、NH4+ |
考点:离子共存问题
专题:离子反应专题
分析:A.通入足量SO2的溶液,显酸性;
B.常温下,c(H+)=10-3mol/L的溶液,显酸性;
C.水电离出的c(OH-)=10-13mol/L的溶液,为酸或碱溶液;
D.遇酚酞显红色的溶液,显碱性.
B.常温下,c(H+)=10-3mol/L的溶液,显酸性;
C.水电离出的c(OH-)=10-13mol/L的溶液,为酸或碱溶液;
D.遇酚酞显红色的溶液,显碱性.
解答:
解:A.通入足量SO2的溶液,显酸性,Fe2+、ClO-发生氧化还原反应,不能大量共存,故A错误;
B.常温下,c(H+)=10-3mol/L的溶液,显酸性,酸性溶液中不能大量存在HCO3-,故B错误;
C.水电离出的c(OH-)=10-13mol/L的溶液,为酸或碱溶液,碱溶液中该组离子之间不反应,可大量共存,故C正确;
D.遇酚酞显红色的溶液,显碱性,碱性溶液中不能大量存在HCO3-、NH4+,且AlO2-促进HCO3-的电离,不能大量共存,故D错误;
故选C.
B.常温下,c(H+)=10-3mol/L的溶液,显酸性,酸性溶液中不能大量存在HCO3-,故B错误;
C.水电离出的c(OH-)=10-13mol/L的溶液,为酸或碱溶液,碱溶液中该组离子之间不反应,可大量共存,故C正确;
D.遇酚酞显红色的溶液,显碱性,碱性溶液中不能大量存在HCO3-、NH4+,且AlO2-促进HCO3-的电离,不能大量共存,故D错误;
故选C.
点评:本题考查离子的共存,为高频考点,把握常见离子之间的反应及习题中的信息为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,注意选项C酸性条件下发生氧化还原反应,题目难度不大.

练习册系列答案
相关题目
高铁电池是一种新型可充电电池,电解质溶液为KOH,放电时的总反应式为:3Zn+2K2FeO4+8H2O?3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| A、充电时阳极反应式为:3Zn(OH)2+6e-═3Zn+6OH- |
| B、放电时OH-向正极移动 |
| C、充电时每转移3mol电子,阳极有1mol Fe(OH)3被还原 |
| D、放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 |
 锌溴液流电池是一种新型电化学储能装置(如图),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A、充电时电极a连接电源的负极 |
| B、放电时负极的电极反应式为Zn-2e-=Zn2+ |
| C、放电时左侧电解质储罐中的离子总浓度增大 |
| D、阳离子交换膜可阻止Br2与Zn直接发生反应 |
用下列实验装置进行相应实验,能达到实验目的是( )
A、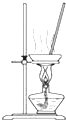 如图所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体 |
B、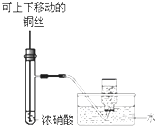 如图所示装置,制备并收集少量NO2气体 |
C、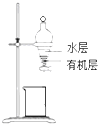 如图所示装置,分离CCl4萃取I2水后的有机层和水层 |
D、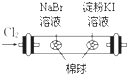 如图所示装置,可以证明氧化性:Cl2>Br2>I2 |
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2.下列有关离子反应或离子方程式的叙述中,正确的是( )
| A、向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- |
| B、向溴水中加入足量氯化亚铁溶液能使溴水变成无色 |
| C、能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 |
| D、向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl- |
在相同条件下,A容器中盛有Cl2,B容器中盛有NH3,若两容器中所含的原子数相等,则A容器与B容器的体积比为( )
| A、2:1 | B、1:3 |
| C、1:2 | D、2:3 |