题目内容
17.下列说法不正确的是( )| A. | 乙烯能与溴的四氯化碳溶液反应使溶液褪色 | |
| B. | 用浸泡过高锰酸钾溶液的硅土保鲜水果 | |
| C. | 无论乙烯还是甲苯,都能使酸性高锰酸钾溶液褪色,这与它们分子内含有碳碳双键有关 | |
| D. | 石油的分馏是物理变化而煤的干馏是化学变化 |
分析 A.乙烯含有碳碳双键;
B.高锰酸钾可氧化乙烯;
C.甲苯不含碳碳双键;
D.分馏根据物质的沸点进行分离,而干馏在隔绝空气条件下发生强热.
解答 解:A.乙烯含有碳碳双键,可与溴发生加成反应,故A正确;
B.乙烯可使水果催熟,高锰酸钾可氧化乙烯,故B正确;
C.甲苯不含碳碳双键,甲基可被高锰酸钾氧化,故C错误;
D.分馏根据物质的沸点进行分离,而干馏在隔绝空气条件下发生强热,发生复杂的氧化还原反应,故D正确.
故选C.
点评 本题考查较综合,涉及有机物的结构与性质、物质鉴别等,为高频考点,注意物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度中等.

练习册系列答案
相关题目
5.下列说法正确的是( )
| A. | 向某固体上滴加稀盐酸,有气泡产生,则该固体一定是碳酸盐 | |
| B. | 把燃着的木条插入某瓶无色气体中,木条熄灭,证明瓶中的气体是二氧化碳 | |
| C. | 取少量溶液于试管中,滴加氯化钡溶液,有白色沉淀生成,证明该溶液中一定有硫酸根离子 | |
| D. | 不用任何试剂就可以把KOH、HNO3、CuSO4、MgCl2四种溶液鉴别出来 |
12.标准状况下,2.24L HCl气体溶于100g水中,溶液密度为ρ g/mL,所得溶液中溶质的物质的量浓度为( )
| A. | 1 mol/L | B. | $\frac{100ρ}{103•65}$ mol/L | ||
| C. | $\frac{ρ}{103.65}$ mol/L | D. | $\frac{0.1ρ}{103•65}$ mol/L |
2.下表各组物质中,物质之间不可能实现如图所示转化的是( )

| 选项 | X | Y | Z | M |
| A | Fe | FeCl2 | FeCl3 | Cl2 |
| B | Mg | C | CO | CO2 |
| C | NaOH | NaCO3 | NaHCO3 | CO2 |
| D | NH3 | NO | NO2 | O2 |
| A. | A | B. | B | C. | C | D. | D |
9.下列鉴别物质的方法能达到目的是( )
| A. | 用KSCN溶液鉴别FeCl3溶液和FeCl2溶液 | |
| B. | .用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 | |
| C. | .用氨水鉴别MgCl2溶液和AlCl3溶液 | |
| D. | .用淀粉溶液鉴别加碘盐和未加碘盐 |
6.下列物质放置在空气中,不是因发生氧化还原反应而发生变质的是( )
| A. | Na2SO3 | B. | Na2O2 | C. | NaOH | D. | FeSO4 |
7.表中的实验内容不能达到实验目的或不能得出相应实验结论的是( )
| 编号 | 实验内容 | 实验目的或实验结论 |
| ① | 向足量的酸性KMnO4溶液中加入乙二醇(HOCH2CH2OH) | 将乙二醇转化为乙二酸(H2C2O4) |
| ② | 向5ml 0.1mol/L AgNO3溶液中滴加1ml 0.1mol/L NaCl溶液,有白色沉淀生成,再向其中滴加1ml 0.1mol/L KI溶液,有黄色沉淀生成. | 验证AgCl的溶解度比AgI大 |
| ③ | 向KI溶液中滴入CuSO4溶液,有白色沉淀生成,但无气体产生,再加入四氯化碳振荡,四氯化碳层呈紫色. | 说明白色沉淀可能为CuI |
| ④ | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入等体积不同浓度的稀硫酸. | 研究浓度对反应速率的影响 |
| ⑤ | 将铁粉投入到盛有稀HNO3的试管中,充分反应后滴入几滴KSCN溶液无明显现象. | 说明HNO3将Fe氧化成Fe2+ |
| A. | ①②⑤ | B. | ②③⑤ | C. | ②③④ | D. | ①②③ |
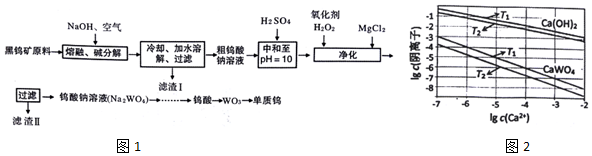
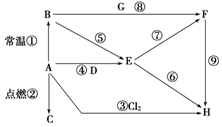 如图表示A~H八种物质的相互转化关系,其中A为金属单质,其余均为化合物,C为淡黄色粉末,D为常见的无色液体,G能使澄清石灰水变浑浊.
如图表示A~H八种物质的相互转化关系,其中A为金属单质,其余均为化合物,C为淡黄色粉末,D为常见的无色液体,G能使澄清石灰水变浑浊.