题目内容
4.下列各溶液中,微粒的物质的量浓度关系正确的是( )| A. | 0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.2mol/L的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| C. | 0.1mol/L的NH4Cl溶液与0.05mol/L的NaOH溶液等体积混合,其混合溶液中:c(Cl-)>c(NH4+)>c(Na+)>c(H+)>c(OH-) | |
| D. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液中:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl) |
分析 A.0.1 mol/L的(NH4)2SO4溶液中铵根离子水解溶液显酸性;
B.溶液中存在质子守恒,水电离出的所有氢氧根离子浓度等于电离出所有氢离子的存在形式;
C.0.1mol/L的NH4Cl溶液与0.05mol/L的NaOH溶液等体积混合得到等浓度的NH4Cl溶液和NH3•H2O溶液,一水合氨电离大于铵根离子水解;
D.氢离子抑制铵根离子水解,碳酸根离子促进铵根离子水解,电离出铵根离子浓度越多的其物质的量浓度越小.
解答 解:A.0.1 mol/L的(NH4)2SO4溶液中铵根离子水解溶液显酸性,溶液中离子浓度大小为::c(NH4+)>c(SO42-)>c(H+)>c(OH-),故A错误;
B.溶液中存在质子守恒,水电离出的所有氢氧根离子浓度等于电离出所有氢离子的存在形式,0.2mol/L的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故B错误;
C.0.1mol/L的NH4Cl溶液与0.05mol/L的NaOH溶液等体积混合得到等浓度的NH4Cl溶液、NaCl溶液和NH3•H2O溶液,一水合氨电离大于铵根离子水解,其混合溶液中:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),故C错误;
D.(NH4)2SO4中含有2个铵根离子,所以铵根离子浓度最大,(NH4)2 CO3中含有2个铵根离子,碳酸根离子和铵根离子相互促进水解,NH4Cl是强酸弱碱盐,铵根离子能水解但较弱;所以当它们物质的量浓度相同时,c(NH4+)大小顺序为(NH4)2SO4>(NH4)2 CO3>NH4Cl,所以如果c(NH4+)相同,电离出铵根离子浓度越多的其物质的量浓度越小,所以当c(NH4+)相同时,物质的量浓度由大到小的顺序为,(NH4)2SO4<(NH4)2 CO3<NH4Cl,故D正确;
故选D.
点评 本题考查了电解质溶液中电荷守恒、物料守恒、离子浓度大小比较、盐类水解等知识点,掌握基础是解题关键,题目难度中等》

 名校课堂系列答案
名校课堂系列答案| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A. | 该反应正反应是放热反应 | |
| B. | 该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0 | |
| C. | 在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100 | |
| D. | 工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高 |
| A. | 醋酸 | B. | 乙醇 | C. | 甲醛 | D. | 葡萄糖 |
| A. | 在任何条件下,纯水都呈中性 | |
| B. | 在任何条件下,纯水的pH=7 | |
| C. | 在95℃时,纯水中 c(H+)<l0-7mol/L | |
| D. | 向纯水中加入少量 NaOH固体,水的电离逆向移动,c(OH-)降低 |
| A. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 | |
| B. | 除去 CO2 中的 HCl 气体,只需将气体通过饱和的 Na2CO3 溶液 | |
| C. | 在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明溶液中一定含 SO42- | |
| D. | 将 0.1mol/L 的 AlCl3 溶液 100mL 逐滴加到 0.1mol/L 的 NaOH 溶液 200ml 中与将 0.1mol/L 的 NaOH 溶液 200ml 逐滴加到 0.1mol/L 的 AlCl3溶液 100mL中,发生的现象和产生沉淀一样多 |
| A. | 乙烯使溴水和酸性高锰酸钾溶液褪色原理相同 | |
| B. | 乙烯分子里所有原子都在同一个平面上,且碳氢键之间的键角约为 120° | |
| C. | 除去乙烷气体中的乙烯可以将混合气体通过盛有足量酸性高锰酸钾溶液的洗气瓶 | |
| D. | 乙烯和环丙烷( 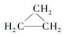 )的分子组成符合通式 CnH2n,因此它们属于同系物 )的分子组成符合通式 CnH2n,因此它们属于同系物 |
| A. | 能跟盐酸反应 | B. | 可溶于水 | ||
| C. | 在空气中易被氧化 | D. | 有磁性 |
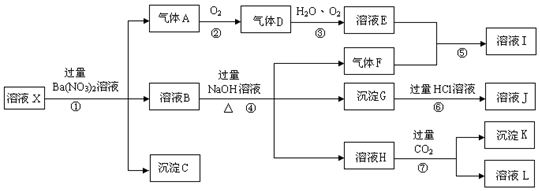
 ,实验中,可以观察到反应②的现象是:无色气体变为红棕色.
,实验中,可以观察到反应②的现象是:无色气体变为红棕色.