题目内容
12.下列三种烃的立体结构如图示: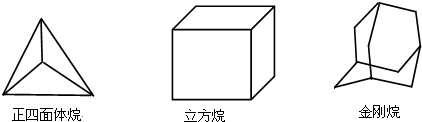
则这三种烃的二氯取代产物的同分异构体数目分别是( )
| A. | 2,4,8 | B. | 2,4,6 | C. | 1,3,6 | D. | 1,3,8 |
分析 先根据氢原子的种类写出一氯代物的种类,烃的二氯代物的同分异构体可以采用固定一个氯原子的方法来寻找.
解答 解:正面体中含有1种氢原子,一氯代物有1种,二氯代物只有1种:两个氯原子在立方体同边有一种情况;
立方烷中含有1种氢原子,一氯代物有1种,二氯代物有3种:两个氯原子在立方体同边有一种情况,两个氯原子的位置在对角有两种情况;
金刚烷的结构可看作是由四个等同的六元环组成的空间构型,分子中含4个-CH-,6个-CH2,分子中含有2氢原子,所以该物质的一氯代物有2种,当次甲基有一个氯原子取代后,二氯代物有3种,当亚甲基有一个氯原子取代后,二氯代物有3种,共6种;
故选C.
点评 本题主要考查同分异构体的书写,难度中等,关键对空间结构有清晰的理解和取代产物的判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列离子方程式正确的是( )
| A. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 往硝酸银溶液中滴加少量氨水:Ag++2NH3═[Ag(NH3)2]+ | |
| C. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- | |
| D. | 石灰石溶于醋酸:CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O |
3.下列叙述中正确的是( )
| A. | 阳离子只有氧化性,阴离子只有还原性 | |
| B. | 含氧酸可作氧化剂而无氧酸则不能 | |
| C. | 金属原子失电子数越多,其还原性越强 | |
| D. | 金属单质在反应中只作还原剂 |
7.下列实验操作先后顺序正确的是( )
| A. | 先装好药品,再检查装置的气密性 | |
| B. | 先用双手握紧试管,再将导管插入水中检查装置气密性 | |
| C. | 结束氢气还原氧化铜的实验时,先熄灭酒精灯后撤出导管 | |
| D. | 稀释硫酸时,先在烧杯里倒入浓硫酸,再小心倒入水并不断搅拌 |
17.已知在25℃,101kPa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
| A. | C8H18(1)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ/mol | |
| B. | C8H18(1)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ/mol | |
| C. | C8H18(1)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l);△;△H=+5518kJ/mol | |
| D. | 2C8H18(1)+25O2(g)=16CO2(g)+18H2O(1);△H=-11036kJ/mol |
1.有关糖类物质概念的叙述中,正确的是)( )
| A. | 糖类是具有甜味的物质 | |
| B. | 糖类是具有Cn(H2O)m通式的物质 | |
| C. | 淀粉是一种白色粉末,本身没有甜味 | |
| D. | 葡萄糖是一种单糖的主要原因是含有醛基 |
2.设NA为阿伏伽德罗常数值.下列有关叙述正确的是( )
| A. | 14g乙烯和丙烯混合气体中的原子数为2NA | |
| B. | 1molN2与4molH2反应生成的NH3分子数为2NA | |
| C. | 1molFe溶于过量硝酸,电子转移数为3NA | |
| D. | 标准状况下,2.24LCCl4含有的共价键数为0.4NA |
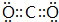
 ,用电子式表示化合物 C2D 的形成过程
,用电子式表示化合物 C2D 的形成过程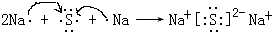 .
.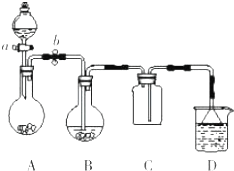 某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).
某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).