题目内容
18.实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称量的NaCl的质量分别是( )| A. | 950mL,111.2g | B. | 500mL,117g | C. | 1000mL,l17g | D. | 任意规格,117g |
分析 配制2mol/L的NaCl溶液950mL,选择1000mL容量瓶,结合m=nM、n=cV计算.
解答 解:配制2mol/L的NaCl溶液950mL,选择1000mL容量瓶,需要NaCl的质量为1L×2mol/L×58.5g/mol=117g,
故选C.
点评 本题考查一定物质的量浓度的溶液配制及计算,为高频考点,把握质量、浓度、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意容量瓶的选择,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.在常温下,将pH=9的NaOH溶液与pH=11的NaOH溶液等体积混合后,溶液的pH最接近于( )
| A. | 9.3 | B. | 9.7 | C. | 10.3 | D. | 10.7 |
9.下列关于有机物的说法正确的是( )
| A. | “西气东输”中的“气”主要成分是甲烷 | |
| B. | 乙烯的结构简式为CH2CH2 | |
| C. | 分子式为C6H6的物质一定是苯 | |
| D. | 乙烯使溴水褪色说明乙烯与溴发生了取代反应 |
6.X、Y、Z、W为四种短周期主族元素,且原子序数依次增大,其中X、Z同族,Y是短周期主族元素中原子半径最大的,X是农作物生长的三种必须营养元素之一,W的单质以前常用于自来水消毒.下列说法正确的是( )
| A. | Z的最高价氧化物的水化物能形成多种含Y元素的盐 | |
| B. | W的氧化物对应水化物的酸性一定强于Z | |
| C. | Y的单质应该保存在水中 | |
| D. | X的氢化物沸点比Z的氢化物沸点低 |
13.通常人体胃液的pH大约是0.9-1.5.胃液的酸碱性为( )
| A. | 碱性 | B. | 酸性 | C. | 无法判定 | D. | 中性 |
10.金属钠着火时,可采用的灭火物质是( )
| A. | CO2 | B. | 水 | ||
| C. | 干沙 | D. | 干粉(含NaHCO3)灭火剂 |
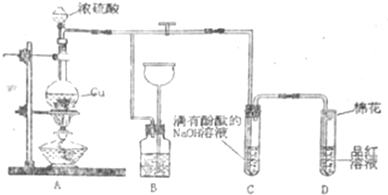
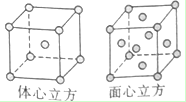 X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,Y元素基态原子核外未成对电子数为2且X与Y形成的化合物在常温下为常见的液体R,Z元素原子最外电子层上s、p电子数相等,W基态原子3d轨道的电子数是4s轨道电子数的3倍.请回答下列问题:
X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,Y元素基态原子核外未成对电子数为2且X与Y形成的化合物在常温下为常见的液体R,Z元素原子最外电子层上s、p电子数相等,W基态原子3d轨道的电子数是4s轨道电子数的3倍.请回答下列问题: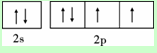 ,其第一电离能在同周期元素中由大到小排第4 位.
,其第一电离能在同周期元素中由大到小排第4 位.