题目内容
合成氨工业上常用下列方法制备H2:
方法:①C(s)+2H2O(g)?CO2(g)+2H2(g)
方法:②CO(g)+H2O(g)?CO2(g)+H2(g)
(1)已知①C(石墨)+O2(g)═CO2(g)△H=-394kJ?mol-1
②C(石墨)+
O2(g)═CO(g)△H=-111kJ?mol-1
③H2(g)+
O2(g)═H2O(g)△H=-242kJ?mol-1
试计算25℃时由方法②制备1000g H2所放出的能量为 kJ.
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g)其相关数据如下表所示:
①T1 T2 (填“>”、“=”或“<”);T1℃时,该反应的平衡常数K= .
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是 .
③一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是 .
A.V逆(CO2)=2V正(H2)
B混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均相对分子质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:

可见在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则从t1到t8哪个时间段H2O(g)的平衡转化率最低 ,t4时刻改变的条件是 .
⑤在25℃时,c mol/L,的醋酸与0.02mol/L NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka= .
方法:①C(s)+2H2O(g)?CO2(g)+2H2(g)
方法:②CO(g)+H2O(g)?CO2(g)+H2(g)
(1)已知①C(石墨)+O2(g)═CO2(g)△H=-394kJ?mol-1
②C(石墨)+
| 1 |
| 2 |
③H2(g)+
| 1 |
| 2 |
试计算25℃时由方法②制备1000g H2所放出的能量为
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g)其相关数据如下表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量 | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 3.5 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是
③一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是
A.V逆(CO2)=2V正(H2)
B混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均相对分子质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:

可见在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则从t1到t8哪个时间段H2O(g)的平衡转化率最低
⑤在25℃时,c mol/L,的醋酸与0.02mol/L NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=
考点:有关反应热的计算,化学平衡状态的判断,化学反应速率与化学平衡图象的综合应用,化学平衡的计算,弱电解质在水溶液中的电离平衡
专题:化学反应中的能量变化,化学平衡专题,电离平衡与溶液的pH专题
分析:(1)应用盖斯定律解题,△H=△H1-△H2-△H3;
(2)①运用平衡移动的原理来分析温度的高低;利用三段式计算平衡时各组分的物质的量,再根据平衡常数k计算;
②随反应进行,物质的浓度降低,反应速率较短,故前1.5min水的浓度变化量大于后1.5min水的浓度变化量,据此解答;
③根据已知条件判断正逆反应速率是否相等;
④该反应是一个反应前后气体体积增大的且是正反应是吸热的化学反应,t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,t8时反应速率增大,但平衡不移动,根据外界条件对化学反应速率的影响来分析解答;
⑤根据电荷守恒可知c(CH3COO-)+c(OH-)=c(Na+)+c(H+),溶液显中性时c(OH-)=c(H+),故c(CH3COO-)=c(Na+),根据溶液的pH值计算溶液中c(H+),根据钠离子浓度计算c(CH3COO-),利用物料守恒计算溶液中c(CH3COOH),溶液中存在平衡CH3COOH?CH3COO-+H+,代入CH3COOH的电离常数表达式Ka=
计算.
(2)①运用平衡移动的原理来分析温度的高低;利用三段式计算平衡时各组分的物质的量,再根据平衡常数k计算;
②随反应进行,物质的浓度降低,反应速率较短,故前1.5min水的浓度变化量大于后1.5min水的浓度变化量,据此解答;
③根据已知条件判断正逆反应速率是否相等;
④该反应是一个反应前后气体体积增大的且是正反应是吸热的化学反应,t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,t8时反应速率增大,但平衡不移动,根据外界条件对化学反应速率的影响来分析解答;
⑤根据电荷守恒可知c(CH3COO-)+c(OH-)=c(Na+)+c(H+),溶液显中性时c(OH-)=c(H+),故c(CH3COO-)=c(Na+),根据溶液的pH值计算溶液中c(H+),根据钠离子浓度计算c(CH3COO-),利用物料守恒计算溶液中c(CH3COOH),溶液中存在平衡CH3COOH?CH3COO-+H+,代入CH3COOH的电离常数表达式Ka=
| c(CH3COO-)c(H+) |
| c(CH3COOH) |
解答:
解:(1)CO(g)+H2O(g)?CO2(g)+H2(g)的,△H=△H1-△H2-△H3=-394kJ?mol-1-(-111kJ?mol-1)-(-242kJ?mol-1)=-41kJ?mol-1,所以制备1000g H2所放出的能量为20500kJ,故答案为:20500;
(2)①如果两者温度相等,甲相对乙,甲平衡时H2(g)平衡量为2.4mol,而是3.2,说明温度改变平衡正向移动,而正反应为吸热反应,所以T1>T2;
由表中数据可知,平衡时氢气的物质的量为3.2mol,则:
C(s)+2H20(g)?C02(g)+2H2(g)
开始(mol):2 4 0 0
转化(mol):1.6 3.2 1.6 3.2
平衡(mol):0.4 0.8 1.6 3.2
平衡常数K=
=
=12.8,
故答案为:>;12.8;
②3min内水蒸气的浓度变化量=氢气的浓度变化量的=
=1.2mol/L,随反应进行,物质的浓度降低,反应速率变小,故前1.5min水的浓度变化量大于后1.5min水的浓度变化量,故反应进行到1.5min时,H2O(g)的物质的量浓度小于2mol/L-1.2mol/L×
=1.4mol/L,
故答案为:<1.4mol/L;
③A.V逆(CO2)=
V逆(H2)=2V正(H2),正逆速度不等,故不选;
B混合气体的密度保持不变,说明气体质量不变,正逆速度相等,故选;
C.c(H2O):c(CO2):c(H2)=2:1:2,而不是不变,故不选;
D.混合气体的平均相对分子质量未平衡时在变,现在保持不变,说明已达平衡状态,故选;故选BD;
④t1到t6平衡都逆向移动,而t6时平衡正向移动,是因为增加反应物的浓度,而C是固体,所以是增加水蒸气的量,所以本身的转化率降低,t8时反应速率增大,但平衡不移动,故平衡转化率最低t7-t8 (或“t7到t8”),t4时刻速率都比原来速率小,平衡逆向,所以是降低温度,故答案为:t7-t8;降低温度;
⑤根据电荷守恒可知c(CH3COO-)+c(OH-)=c(Na+)+c(H+),溶液显中性时c(OH-)=c(H+),故c(CH3COO-)=c(Na+),溶液中c(OH-)=10-7mol/L,溶液中c(CH3COO-)=c(Na+)=
×0.02mol?L-1=0.01mol?L-1,故混合后溶液中c(CH3COOH)=
×cmol?L-1-0.01mol?L-1=(0.5c-0.01)mol/L,CH3COOH的电离常数Ka=
=
,
故答案为:
.
(2)①如果两者温度相等,甲相对乙,甲平衡时H2(g)平衡量为2.4mol,而是3.2,说明温度改变平衡正向移动,而正反应为吸热反应,所以T1>T2;
由表中数据可知,平衡时氢气的物质的量为3.2mol,则:
C(s)+2H20(g)?C02(g)+2H2(g)
开始(mol):2 4 0 0
转化(mol):1.6 3.2 1.6 3.2
平衡(mol):0.4 0.8 1.6 3.2
平衡常数K=
| c(CO2)c2(H2) |
| c2(H2O) |
| 1.6×3.22 |
| 0.82 |
故答案为:>;12.8;
②3min内水蒸气的浓度变化量=氢气的浓度变化量的=
| 1.2mol |
| 1L |
| 1 |
| 2 |
故答案为:<1.4mol/L;
③A.V逆(CO2)=
| 1 |
| 2 |
B混合气体的密度保持不变,说明气体质量不变,正逆速度相等,故选;
C.c(H2O):c(CO2):c(H2)=2:1:2,而不是不变,故不选;
D.混合气体的平均相对分子质量未平衡时在变,现在保持不变,说明已达平衡状态,故选;故选BD;
④t1到t6平衡都逆向移动,而t6时平衡正向移动,是因为增加反应物的浓度,而C是固体,所以是增加水蒸气的量,所以本身的转化率降低,t8时反应速率增大,但平衡不移动,故平衡转化率最低t7-t8 (或“t7到t8”),t4时刻速率都比原来速率小,平衡逆向,所以是降低温度,故答案为:t7-t8;降低温度;
⑤根据电荷守恒可知c(CH3COO-)+c(OH-)=c(Na+)+c(H+),溶液显中性时c(OH-)=c(H+),故c(CH3COO-)=c(Na+),溶液中c(OH-)=10-7mol/L,溶液中c(CH3COO-)=c(Na+)=
| 1 |
| 2 |
| 1 |
| 2 |
| 10-7×0.01 |
| 0.5c-0.01 |
| 2×10-9 |
| c-0.02 |
故答案为:
| 2×10-9 |
| c-0.02 |
点评:本题考查了热化学方程式和盖斯定律的计算应用,化学平衡常数的影响因素判断,电离平衡,属于拼合型题目,对学生的心理有较高的要求,掌握基础是关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
分析如图装置,下列说法错误的是( )
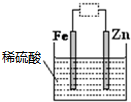

| A、虚线框中接直流电源,铁可能会被腐蚀 |
| B、虚线框中接灵敏电流计或接直流电源,锌都是负极 |
| C、虚线框中接灵敏电流计,该装置可将化学能转化为电能 |
| D、若将电解液改成硫酸锌溶液并接上直流电源,该装置可用于铁皮上镀锌 |
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水.工业上常通过以下两步反应制备K2FeO4:①2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O ②Na2FeO4+2KOH═K2FeO4+2NaOH
下列说法不正确的是( )
下列说法不正确的是( )
| A、反应①为氧化还原反应,反应②为复分解反应 |
| B、反应①中Na2FeO4是还原产物 |
| C、Na2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒 |
| D、若有2 mol FeCl3 发生反应,转移电子的物质的量为 6mol |
化工生产要遵守三大原则:充分利用原料、充分利用能量、保护环境.下列描述不符合以上某原则的是( )
| A、煅烧硫铁矿使用沸腾炉 |
| B、制盐酸时将氢气在氯气中燃烧 |
| C、制硫酸时使用热交换器 |
| D、合成氨时氮气和氢气循环使用 |
 Ⅰ.CN-能与Ni2+形成[Ni(CN)4]2-配离子
Ⅰ.CN-能与Ni2+形成[Ni(CN)4]2-配离子