题目内容
4.如图所示的实验,能达到实验目的是( )| A | B | C | D |
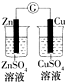 | 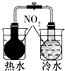 | 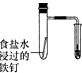 | 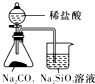 |
| 验证化学能转化为电能 | 验证温度对平衡移动的影响 | 验证铁发生析氢腐蚀 | 验证非金属Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
分析 A.没有构成闭合回路;
B.存在NO2?N2O4,温度高颜色深;
C.电解质溶液呈中性,发生吸氧腐蚀;
D.比较非金属性,应根据最高价含氧酸的酸性强弱比较.
解答 解:A.没有构成闭合回路,不能发生原电池反应,故A错误;
B.存在NO2?N2O4,温度高颜色深,可知温度对化学平衡的影响,故B正确;
C.电解质溶液呈中性,发生吸氧腐蚀,如为酸性,则发生析氢腐蚀,故C错误;
D.比较非金属性,应根据最高价含氧酸的酸性强弱比较,不能用盐酸,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及原电池、化学平衡、化学腐蚀及非金属性的比较等知识,把握化学反应原理、实验技能等为解答的关键,侧重分析与实验能力的考查,选项D是易错点,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
14.150℃,101kPa下,将下列有机物分别与足量的空气混合,引燃反应后恢复到原来的温度和压强,气体体积不变的是( )
| A. | C2H6 | B. | C2H4 | C. | C3H8 | D. | C3H6 |
15.决定化学反应速率的主要原因是( )
| A. | 物质本身的性质 | B. | 反应物的浓度 | ||
| C. | 反应的温度 | D. | 反应物间的接触面积 |
12.甲烷分子中的四个氢原子都可以被取代.若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示,对所得分子的描述,正确的是( )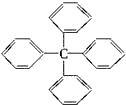

| A. | 此物质分子式为C25H18,属于苯的同系物 | |
| B. | 其一氯代物共有四种 | |
| C. | 此分子最多有13个碳原子在一个平面上 | |
| D. | 该物质能使溴水因化学反应而褪色 |
16.向10mL 0.1mol•L-1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是( )
| A. | x=10时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-) | |
| B. | x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+) | |
| C. | x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-) | |
| D. | x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+) |
13.下列分离或提纯物质的方法正确的是( )
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | 硬脂酸钠 | 甘油,水 | 加NaCl | 盐析 |
| B | 乙烷 | 乙烯 | 通过KMnO4(H+)溶液 | 洗气 |
| C | C6H6 | Br2 | 加苯酚 | 过滤 |
| D | 乙酸乙酯 | 乙酸 | 氢氧化钠溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
7.现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,该同位素中子数为8,这种同位素的符号是14C.
(2)Y的氢化物与Y的最高价氧化物的水化物反应生成的物质名称为:硝酸铵
(3)Z所在族元素的四种氢化物中,沸点最低的物质的化学式为:HCl
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填分子式),阐述理由是碳酸为弱酸,其余三种酸为强酸.
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的3/8 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)Y的氢化物与Y的最高价氧化物的水化物反应生成的物质名称为:硝酸铵
(3)Z所在族元素的四种氢化物中,沸点最低的物质的化学式为:HCl
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填分子式),阐述理由是碳酸为弱酸,其余三种酸为强酸.
 ,A的结构简式CH2=CH2.
,A的结构简式CH2=CH2. ,反应类型取代反应.
,反应类型取代反应.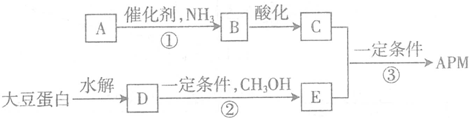
 ,C中所含官能团的名称为羧基、氨基.
,C中所含官能团的名称为羧基、氨基. .
.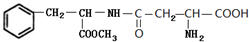 和
和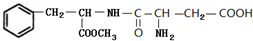 .
.