题目内容
元素周期表是学习化学的重要工具,它隐含许多信息和规律.
(1)用元素符号标出氧、钠、镁、铝、硫、氯在周期表中对应位置(以下为周期表的一部分)
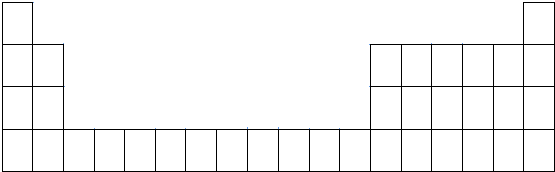
(2)铝元素处于周期表中 周期 族.
(3)上述六种元素的高价氧化物对应的水化物酸性最强的是 (填化学式).
(4)写出氧化铝和氢氧化钠溶液反应的离子方程式: .
(5)用电子式表示镁和氯形成化合物的过程: .
(1)用元素符号标出氧、钠、镁、铝、硫、氯在周期表中对应位置(以下为周期表的一部分)

(2)铝元素处于周期表中
(3)上述六种元素的高价氧化物对应的水化物酸性最强的是
(4)写出氧化铝和氢氧化钠溶液反应的离子方程式:
(5)用电子式表示镁和氯形成化合物的过程:
考点:元素周期律和元素周期表的综合应用
专题:
分析:(1)根据原子电子层数、最外层电子数确定在周期表中的位置;
(2)铝原子核外有3个电子层、最外层有3个电子,主族元素原子电子层数与其周期数相等、最外层电子数与其族序数相等;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
(4)氧化铝属于两性氧化物,能和NaOH溶液反应生成偏铝酸钠和水;
(5)Mg原子和Cl原子之间通过得失电子形成离子化合物氯化镁.
(2)铝原子核外有3个电子层、最外层有3个电子,主族元素原子电子层数与其周期数相等、最外层电子数与其族序数相等;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
(4)氧化铝属于两性氧化物,能和NaOH溶液反应生成偏铝酸钠和水;
(5)Mg原子和Cl原子之间通过得失电子形成离子化合物氯化镁.
解答:
解:(1)O元素位于第二周期第VIA族、Na元素位于第三周期第IA族、Mg元素位于第三周期第IIA族、Al元素位于第三周期第IIIA族、S元素位于第三周期第VIA族、Cl元素位于第三周期第VIIA族,所以其在周期表中的位置为 ,
,
故答案为: ;
;
(2)铝原子核外有3个电子层、最外层有3个电子,主族元素原子电子层数与其周期数相等、最外层电子数与其族序数相等,所以Al位于第三周期第IIIA族,故答案为:第三;第IIIA;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,除了O元素为,非金属性最强的元素是Cl元素,则酸性最强的酸是HClO4,故答案为:HClO4;
(4)氧化铝属于两性氧化物,能和NaOH溶液反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(5)Mg原子和Cl原子之间通过得失电子形成离子化合物氯化镁,其形成过程为 ,故答案为:
,故答案为: .
.
 ,
,故答案为:
 ;
;(2)铝原子核外有3个电子层、最外层有3个电子,主族元素原子电子层数与其周期数相等、最外层电子数与其族序数相等,所以Al位于第三周期第IIIA族,故答案为:第三;第IIIA;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,除了O元素为,非金属性最强的元素是Cl元素,则酸性最强的酸是HClO4,故答案为:HClO4;
(4)氧化铝属于两性氧化物,能和NaOH溶液反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(5)Mg原子和Cl原子之间通过得失电子形成离子化合物氯化镁,其形成过程为
 ,故答案为:
,故答案为: .
.
点评:本题考查元素周期表和元素周期律的综合应用,涉及元素周期律知识、电子式、元素在周期表中的位置确定等知识点,熟悉元素周期表结构、原子结构即可解答,难点是用电子式表示物质形成过程.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A、太阳能电池板中的硅,在元素周期表中处于金属与非金属的交界位置 |
| B、煤的气化或液化技术,可以降低污染 |
| C、镁粉可用来作信号弹和烟花,氧化镁可制作耐高温材料 |
| D、NaHCO3能与碱反应,因此食品工业用小苏打做焙制糕点的膨松剂 |
实验室制乙酸乙酯1mL后,沿器壁加入紫色石蕊试液0.5mL,这时石蕊试液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡).对可能出现的现象,下列叙述中正确的是( )
| A、石蕊层仍为紫色,有机层无色 |
| B、石蕊层为三层环,由上而下是红、紫、红 |
| C、石蕊层有两层,上层为紫色,下层为蓝色 |
| D、石蕊层为三层环,由上而下是蓝、紫、红 |
为确定下列久置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的是( )
| A、Na2SO3溶液(BaCl2) |
| B、FeCl2溶液(KSCN) |
| C、KI(淀粉溶液) |
| D、NaOH溶液(盐酸) |

 为了制取干燥纯净的气体C,可用如下图所示装置.生成C的速度可通过调节滴入液体A的速度的方法来控制,已知C是一种无色无味、不能使酸碱指示剂变色,也不会在空气中燃烧的气体.
为了制取干燥纯净的气体C,可用如下图所示装置.生成C的速度可通过调节滴入液体A的速度的方法来控制,已知C是一种无色无味、不能使酸碱指示剂变色,也不会在空气中燃烧的气体.
