题目内容
20.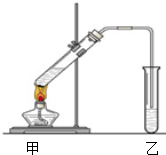 (1)配置混合溶液时,加入试剂的正确顺序是A(填“A”或“B”);
(1)配置混合溶液时,加入试剂的正确顺序是A(填“A”或“B”);A.先加入乙醇,再慢慢注入浓硫酸和乙酸
B.先加入浓硫酸,再慢慢注入乙醇和乙酸
(2)在装置中乙试管常加入B来接收乙酸乙酯;
A.NaOH溶液 B.饱和Na2CO3溶液C.NaCl溶液 D.CuSO4溶液
(3)若要将乙试管中的乙酸乙酯分离出来,应采用的实验操作是分液(填操作名称);
(4)写出制取乙酸乙酯反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O.
分析 (1)类比浓硫酸的稀释进行判断;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,乙醇溶解,碳酸钠与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
(3)分离互不相溶的液体,可用分液的方法分离;
(4)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应.
解答 解:(1)浓硫酸的稀释是将浓硫酸加入水中,边加边搅拌,迁移到此处,即将浓硫酸加入到乙醇中,边摇动试管边慢慢加入浓硫酸和醋酸,所以正确是A,
故答案为:A;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层,所以B正确,
故答案为:B;
(3)分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯,
故答案为:分液;
(4)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,同时该反应可逆,反应的化学方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O.
点评 本题考查乙酸乙酯的制备,注意实验混合液的配制、饱和碳酸钠溶液的作用以及酯化反应的机理,本题难度中等,侧重于考查学生的实验能力和对基础知识的应用能力.

练习册系列答案
相关题目
19.鉴别甲烷、乙烯、乙炔三种气体可采用的方法是( )
| A. | 通入溴水中,观察溴水是否褪色 | |
| B. | 通入酸性高锰酸钾溶液中,观察颜色变化 | |
| C. | 点燃,检验燃烧产物 | |
| D. | 点燃,观察火焰明亮程度及产生黑烟量的多少 |
12.铁与水蒸气反应的实验装置如图,下列说法正确的是( )
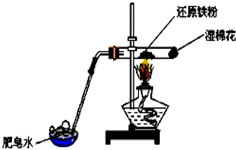

| A. | 实验时,试管口应高于试管底 | |
| B. | 加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声 | |
| C. | 反应的化学方程式为:2Fe+3H2O(g) $\frac{\underline{\;\;△\;\;}}{\;}$ Fe2O3+3H2 | |
| D. | 实验结束后如果固体仍为黑色,说明原反应没有发生 |
 乙酸乙酯是重要的有机物,某化学兴趣小组对乙酸乙酯的制取进行探究活动.
乙酸乙酯是重要的有机物,某化学兴趣小组对乙酸乙酯的制取进行探究活动. 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料. 硫酸和纯碱都属于工业上常用的“三酸两碱”.回答下列问题:
硫酸和纯碱都属于工业上常用的“三酸两碱”.回答下列问题: