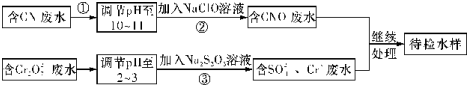
题目内容
8. 乙酸乙酯是重要的有机物,某化学兴趣小组对乙酸乙酯的制取进行探究活动.
乙酸乙酯是重要的有机物,某化学兴趣小组对乙酸乙酯的制取进行探究活动.【查阅资料】乙酸乙酯:无色,有芬芳气味的液体,沸点77℃,熔点-83.6℃,密度0.901g/cm3,溶于乙醇,氯仿,乙醚和苯等,微溶于水,在饱和碳酸钠溶于中溶解度更小.
【反应原理】
CH3COOH+CH3CH2OH$?_{加热}^{浓硫酸}$CH3COOC2H5+H2O
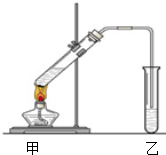
【实验探究】某化学兴趣小组设计如图装置进行实验,在100ml圆底瓶内加入碎瓷片后,加入5mL乙醇,边振荡边加入5mL98%的浓H2SO4,冷却后再加入15mL乙醇,通过仪器A向B内加入12mL冰醋酸,点燃酒精灯加热,在烧杯D中加入饱和Na2CO3溶液.
(1)装置中仪器A的名称是分液漏斗
(2)装置中球形干燥管C的作用防止倒吸
(3)反应中加入浓硫酸的作用是B(填字母代号,下同)A.只作催化剂B.只作吸水剂C.催化剂和吸水剂D.氧化剂
(4)实验中饱和碳酸钠溶液的作用是D
A.中和乙酸乙酯
B.加速酯的生成,提高其产率
C.中和乙酸和乙醇
D.降低乙酸乙酯的溶解度,有利于分层析出
(5)反应结束时D中的现象是B
A.没有气泡冒出
B.有细小的气泡冒出,溶液分层,无色油状液体在上层
C.溶液不分层
D.溶液分层,无色油状液体在下层
(6)欲将D中的物质分离得到乙酸乙酯,必须使用分液漏斗,分离时,乙酸乙酯应该从分液漏斗上口倒出(填“下口放”或“上口倒”)
分析 (1)根据装置图,仪器A的名称是分液漏斗;
(2)球形干燥管的体积较大,能防倒吸;
(3)酯化反应为可逆反应,且浓硫酸具有吸水性;
(4)饱和碳酸钠溶液可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度;
(5)醇与乙酸都易挥发,制备的乙酸乙酯含有乙醇与乙酸,通常用饱和碳酸钠溶液吸收乙酸乙酯,除去乙酸时放出二氧化碳气体,乙酸乙酯不溶于饱和碳酸钠溶液,密度比水小;
(6)乙酸乙酯不溶于碳酸钠溶液,可以通过分液操作分离,乙酸乙酯的密度较小,在混合液上层.
解答 解:(1)根据装置图,仪器A的名称是分液漏斗,故答案为:分液漏斗;
(2)球形干燥管体积大,可以防止倒吸,故答案为:防止倒吸;
(3)酯化反应为可逆反应,且浓硫酸具有吸水性,促进反应向右进行,则浓硫酸的作用为催化剂、吸水剂,故选:C;
(4)饱和碳酸钠溶液可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,只有D符合,故选:D;
(5)饱和碳酸钠溶液可吸收乙醇、除去乙酸时放出二氧化碳气体,而乙酸乙酯不溶于饱和碳酸钠溶液,密度比水小,溶液分层,上层无色油体液体,所以反应结束时D中的现象是有细小的气泡冒出,溶液分层,无色油状液体在上层,故选:B;
(6)乙酸乙酯不溶于碳酸钠溶液,乙酸乙酯遇碳酸钠溶液,混合液会分层,由于乙酸乙酯密度小于碳酸钠溶液,分液时从分液漏斗的上口倒出,故答案为:上口倒.
点评 本题考查了乙酸乙酯的制备方法,注意把握乙酸乙酯的制备原理和实验方法,明确乙酸乙酯与乙酸、乙醇性质的区别方法及浓硫酸的作用.题目难度中等.

练习册系列答案
相关题目
6.下列反应的热效应与其它三项不相同的是( )
| A. | 氯化铵与Ba(OH)2•8H2O反应 | B. | 钠与冷水反应 | ||
| C. | 锌片与稀硫酸反应 | D. | 铝粉与三氧化二铁的反应 |
7.在下列各说法中,正确的是( )
| A. | △H>0表示放热反应,△H>0表示吸热反应 | |
| B. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 | |
| C. | 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热量叫做中和热 | |
| D. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
4.下列物质中含有相同的化学键类型的是( )
| A. | NaCl、HCl、H2O、NaOH | B. | Cl2、Na2S、HCl、SO2 | ||
| C. | Na2O2、H2O2、H2O、O3 | D. | HBr、CO2、H2O、CS2 |
17.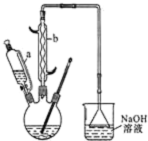 己二酸
己二酸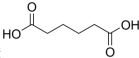 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:

可能用到的有关数据如下:
实验步骤如下;
Ⅰ、在三口烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品.V、粗产品经提纯后称重为5.7g.
请回答下列问题:
(1)滴液漏斗的细支管a的作用是平衡滴液漏斗与三口烧瓶内的压强,使环己醇能够顺利流下,仪器b的名称为球形冷凝管(或冷凝管).
(2)已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH═NaNO2+NaNO3+H2O NO+NO2+2NaOH═2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:2NO2+Na2CO3=NaNO2+NaNO3+CO2、NO+NO2+Na2CO3=2NaNO2+CO2.
(3)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则.可能造成较严重的后果,试列举一条可能产生的后果:反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的NO2气体来不及被碱液吸收而外逸到空气中.
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和苯洗涤晶体.
(5)粗产品可用重结晶法提纯(填实验操作名称).本实验所得到的己二酸产率为75%.
 己二酸
己二酸 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
可能用到的有关数据如下:
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 己二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
Ⅰ、在三口烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品.V、粗产品经提纯后称重为5.7g.
请回答下列问题:
(1)滴液漏斗的细支管a的作用是平衡滴液漏斗与三口烧瓶内的压强,使环己醇能够顺利流下,仪器b的名称为球形冷凝管(或冷凝管).
(2)已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH═NaNO2+NaNO3+H2O NO+NO2+2NaOH═2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:2NO2+Na2CO3=NaNO2+NaNO3+CO2、NO+NO2+Na2CO3=2NaNO2+CO2.
(3)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则.可能造成较严重的后果,试列举一条可能产生的后果:反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的NO2气体来不及被碱液吸收而外逸到空气中.
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和苯洗涤晶体.
(5)粗产品可用重结晶法提纯(填实验操作名称).本实验所得到的己二酸产率为75%.
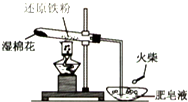 为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.
为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.
 (1)配置混合溶液时,加入试剂的正确顺序是A(填“A”或“B”);
(1)配置混合溶液时,加入试剂的正确顺序是A(填“A”或“B”);