题目内容
NH3?H2O的电离平衡常数为Kb=
.氨水中各离子和分子的浓度大小为( )
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| A、c(NH4+)=c(OH-)=c(NH3?H2O) |
| B、c(NH4+)>c(OH-)>c(NH3?H2O) |
| C、c(NH4+)=c(OH-)>c(NH3?H2O) |
| D、c(NH4+)<c(OH-)<c(NH3?H2O) |
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:NH3?H2O为弱电解质,不能完全电离,碘电离程度较小,溶液中c(NH3?H2O)最大,且还存在水的电离,以此解答.
解答:
解:NH3?H2O为弱电解质,不能完全电离,碘电离程度较小,溶液中c(NH3?H2O)最大,
因还存在水的电离,则c(NH4+)<c(OH-),
故有c(NH4+)<c(OH-)<c(NH3?H2O),
故选D.
因还存在水的电离,则c(NH4+)<c(OH-),
故有c(NH4+)<c(OH-)<c(NH3?H2O),
故选D.
点评:本题考查弱电解质的电离,为高频考点,侧重于学生的分析能力的考查,注意把握弱电解质的电离特点,难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案
相关题目
2.24L某气体在标准状况下的质量为3.2g,该气体的摩尔质量约为( )
| A、64g?mol-1 |
| B、64 |
| C、32g?mol-1 |
| D、64g |
等质量的铝粉,分别与等体积的氢氧化钠溶液和硫酸恰好完全反应,则氢氧化钠溶液和硫酸的物质的量浓度之比是( )
| A、2:3 | B、3:2 |
| C、1:1 | D、1:2 |
下列物质互为同分异构体的是( )
A、
| ||||
| B、氧气和臭氧 | ||||
| C、甲烷和乙烷 | ||||
| D、正丁烷和异丁烷 |
今有pH=10的Na2CO3溶液、pH=10的NaOH溶液和pH=4的CH3COOH溶液.若上述三种溶液中水的电离度分别为α1、α2、α3,下列关系正确的是( )
| A、α1=α2=α3 |
| B、α1>α2>α3 |
| C、α1>α2=α3 |
| D、α1=α2<α3 |
下列说法正确的是( )
| A、需要加热才能发生的反应一定是吸热反应 |
| B、放热反应在常温下一定很容易发生 |
| C、化学反应除了生成新的物质外,还伴随着能量的变化 |
| D、吸热反应不加热就不会发生 |
 已知:在热力学标准状态下(298K、1.01×105Pa),由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H ).如图为氧族元素氢化物a、b、c、d的生成热数据示意图.下列叙述不正确的是( )
已知:在热力学标准状态下(298K、1.01×105Pa),由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H ).如图为氧族元素氢化物a、b、c、d的生成热数据示意图.下列叙述不正确的是( )



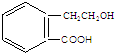 ,它可通过不同化学反应分别制得B、C、D 和E四种物质.
,它可通过不同化学反应分别制得B、C、D 和E四种物质.