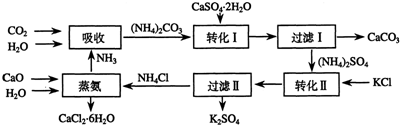
题目内容
10.在下列反应中:A.2F2+2H2O═4HF+O2
B.2Na+2H2O═2NaOH+H2↑
C.CaO+H2O═Ca(OH)2
D.2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑
(1)水只作氧化剂的是B(填字母序号,下同),水只作还原剂的是A,水既作氧化剂又作还原剂的是D,水既不作氧化剂又不作还原剂的是C.
(2)用双线桥法表示D反应中电子转移情况
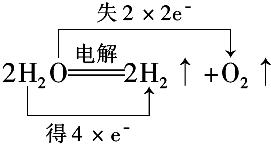 .
.
分析 (1)水只作氧化剂,说明水中元素得电子化合价降低;水只作还原剂说明水中元素失电子化合价升高;水既是氧化剂又是还原剂,说明水中元素化合价升高和降低;水既不是氧化剂又不是还原剂,说明水中各元素化合价不变;
(2)D中H元素化合价由+1价变为0价、O元素化合价由-2价变为0价,转移电子数为4.
解答 解:(1)A.F元素化合价由0价变为-1价、O元素化合价由-2价变为0价,所以水作还原剂;
B.Na元素化合价由0价变为+2价、H元素化合价由+1价变为0价,所以水是氧化剂;
C.该反应中各元素化合价不变,所以不是氧化还原反应;
D.该反应中H元素化合价由+1价变为0价、O元素化合价由-2价变为0价,所以氧化剂和还原剂,
通过以上分析知,水只作氧化剂的是B、水只作还原剂的是A,水既作氧化剂又作还原剂的是D,水既不作氧化剂又不作还原剂的是C,故答案为:B;A;D;C;
(2)D中H元素化合价由+1价变为0价、O元素化合价由-2价变为0价,转移电子数为4,电子转移方向和数目为 ,
,
故答案为: .
.
点评 本题考查氧化还原反应,侧重考查基本概念及电子转移方向和数目判断,根据元素化合价变化确定物质性质,难点是电子转移方向和数目判断.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案
相关题目
1.科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.
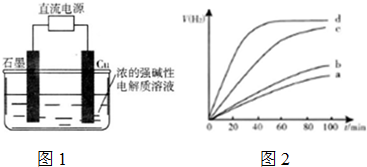
I.四种制取Cu2O的方法:
a.用炭粉在高温条件下还原CuO制备Cu2O;
b.用葡萄糖还原新制的Cu(OH)2制备Cu2O;
c.电解法制备Cu2O,装置如图1;
d.湿化学法:加热条件下用液态肼(N2H4)还原新制Cu(OH)2
可制备纳米级Cu2O,同时放出N2.
(1)方法c通过阳极氧化制得Cu2O,写出阳极的电极反应式2Cu+2OH--2e-=Cu2O+H2O.
(2)方法d的化学方程式为N2H4+4Cu(OH)2=2Cu2O+N2↑+6H2O,检验纳米Cu2O(粒子大小约几十纳米)已经生成的实验方法是丁达尔效应.
(3)方法d得到的产品中常含有Cu2O称取某产品3.52g(仅含Cu2O和Cu),加入足量的稀硝酸,充分反应后得到标准状况下的NO气体448mL,则产品中Cu2O的质量分数为81.8%.
Ⅱ.用制得的Cu2O进行催化分解水的实验
(4)一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气,发生反应:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H═+484KJ•mol-1
不同时段产生O2的物质的量见下表:
前20min的反应平均速率v(H2O)=5.0×10-5 mol.L-1.min -1,达平衡时,至少需要吸收的光能为0.968kJ.
(5)用以上四种方法制得的Cu2O在某相同条件下分别对水催化分解,产生氢气的体积V(H2)随时间t变化如图2.
下列叙述正确的是ACD(填字母代号).
A.c、d方法制得的Cu2O催化效率相对较高
B.d方法制得的Cu2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有关
D.Cu2O催化水分解时,需要适宜的温度.

I.四种制取Cu2O的方法:
a.用炭粉在高温条件下还原CuO制备Cu2O;
b.用葡萄糖还原新制的Cu(OH)2制备Cu2O;
c.电解法制备Cu2O,装置如图1;
d.湿化学法:加热条件下用液态肼(N2H4)还原新制Cu(OH)2
可制备纳米级Cu2O,同时放出N2.
(1)方法c通过阳极氧化制得Cu2O,写出阳极的电极反应式2Cu+2OH--2e-=Cu2O+H2O.
(2)方法d的化学方程式为N2H4+4Cu(OH)2=2Cu2O+N2↑+6H2O,检验纳米Cu2O(粒子大小约几十纳米)已经生成的实验方法是丁达尔效应.
(3)方法d得到的产品中常含有Cu2O称取某产品3.52g(仅含Cu2O和Cu),加入足量的稀硝酸,充分反应后得到标准状况下的NO气体448mL,则产品中Cu2O的质量分数为81.8%.
Ⅱ.用制得的Cu2O进行催化分解水的实验
(4)一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气,发生反应:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H═+484KJ•mol-1
不同时段产生O2的物质的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| N(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
(5)用以上四种方法制得的Cu2O在某相同条件下分别对水催化分解,产生氢气的体积V(H2)随时间t变化如图2.
下列叙述正确的是ACD(填字母代号).
A.c、d方法制得的Cu2O催化效率相对较高
B.d方法制得的Cu2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有关
D.Cu2O催化水分解时,需要适宜的温度.
18.在物质分类中,前者包括后者的是( )
| A. | 氧化物、化合物 | B. | 非电解质、化合物 | C. | 溶液、胶体 | D. | 分散系、溶液 |
5.已知锂及其化合物的许多性质与碱金属差异较大,却与镁相似.下面有关锂及其化合物的性质的叙述不正确的是( )
| A. | 锂在过量氧气中燃烧,主要产物是Li2O而不是Li2O2 | |
| B. | Li2CO3受热很难分解 | |
| C. | 在相同温度下,溶解度Li2CO3小于LiHCO3 | |
| D. | 少量的锂保存在固体石蜡中 |
2.下面三种方法都可以制得Cl2:
①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑
②2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑
③O2+4HCl(g)$\frac{\underline{\;催化剂\;}}{500℃}$2H2O+2Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )
①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑
②2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑
③O2+4HCl(g)$\frac{\underline{\;催化剂\;}}{500℃}$2H2O+2Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )
| A. | O2>MnO2>KMnO4 | B. | KMnO4>MnO2>O2 | C. | MnO2>KMnO4>O2 | D. | O2>KMnO4>MnO2 |
19.在0.25mol 硫酸钠中,含有的氧原子数约为( )
| A. | 1个 | B. | 0.25个 | C. | 6.02×1023个 | D. | 5×1023个 |
20.下列原子中,最难形成离子的是( )
| A. |  | B. |  | C. |  | D. |  |