题目内容
15.将磷肥生产中形成的副产物石膏(CaSO4•2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图.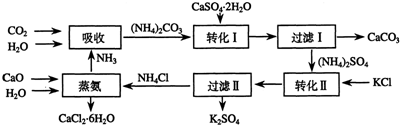
(1)本工艺中所用的原料除CaSO4•2H2O、CaCO3、H2O外,还需要KCl、NH3等原料.
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:CaSO4+CO32-=CaCO3+SO42-
(3)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32-的操作方法是:用滴管取少量滤液于试管中,滴加盐酸,若产生气泡,证明滤液中含有CO32-.
(4)若过滤I的滤液中的Ca2+浓度低于1.0×10-5 mol•L-1时可认为被沉淀完全.若要使Ca2+沉淀完全,则滤液中CO32-离子的物质的量浓度不得低于5.0×-4mol/L.
(已知:Ksp(CaCO3)=5.0×10-9)
(5)转化Ⅱ之所以能够实现的原因是硫酸钾的溶解度小于硫酸铵.
(6)写出蒸氨过程中的化学方程式CaO+2NH4Cl+5H2O=CaCl2•6H2O+2NH3↑.
(7)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是ad
a.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒.
分析 由制备流程可知,吸收环节中发生2NH3、CO2、H2O反应生成碳酸铵;转化Ⅰ环节中发生碳酸铵和石膏悬浊液反应生成CaCO3、(NH4)2SO4,经过滤后分离;转化Ⅱ中(NH4)2SO4和KCl的饱和溶液反应得到NH4Cl和K2SO4,经过滤Ⅱ分离出K2SO4;蒸氨环节中为CaO、H2O、NH4Cl生成为CaCl2.6H2O和NH3.氨气在流程中可循环使用,然后结合物质的性质及混合物分离提纯来解答.
解答 解:由制备流程可知,吸收环节中发生2NH3、CO2、H2O反应生成碳酸铵;转化Ⅰ环节中发生碳酸铵和石膏悬浊液反应生成CaCO3、(NH4)2SO4,经过滤后分离;转化Ⅱ中(NH4)2SO4和KCl的饱和溶液反应得到NH4Cl和K2SO4,经过滤Ⅱ分离出K2SO4;蒸氨环节中为CaO、H2O、NH4Cl生成为CaCl2.6H2O和NH3.
(1)由流程涉及的物质可知,本工艺中所用的原料除CaSO4•2H2O、CaCO3、H2O外,还需要KCl、NH3,故答案为:KCl、NH3;
(2)石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式为CaSO4+CO32-=CaCO3+SO42-,故答案为:CaSO4+CO32-=CaCO3+SO42-;
(3)碳酸根离子与酸反应能生成二氧化碳,则可以用稀盐酸来验证碳酸根离子,方法为用滴管取少量滤液于试管中,滴加盐酸,若产生气泡,证明滤液中含有CO32-,
故答案为:用滴管取少量滤液于试管中,滴加盐酸,若产生气泡,证明滤液中含有CO32-;
(4)Ksp(CaCO3)=5.0×10-9,要使Ca2+沉淀完全,则滤液中CO32-离子的物质的量浓度不得低于$\frac{5.0×1{0}^{-9}}{1.0×1{0}^{-5}}$=5.0×-4mol/L,故答案为:5.0×-4mol/L;
(5)转化Ⅱ之所以能够实现的原因是硫酸钾的溶解度小于硫酸铵,故答案为:硫酸钾的溶解度小于硫酸铵;
(6)由流程图转化可知,原料为CaO、H2O、NH4Cl产物为CaCl2.6H2O和NH3,反应为CaO+2NH4Cl+5H2O=CaCl2•6H2O+2NH3↑,故答案为:CaO+2NH4Cl+5H2O=CaCl2•6H2O+2NH3↑;
(7)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,是因为氯化钙结晶水合物熔点低易熔化,且无毒,与易溶于水,与导电、制冷无关,
故答案为:ad.
点评 本题考查物质的制备及混合物分离提纯的综合应用,为高频考点,把握制备流程中的反应及混合物分离方法为解答的关键,侧重分析、推断及实验能力的综合考查,注意反应原理的分析及应用,题目难度中等.

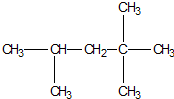 作为汽车动力燃料的汽油,其主要成份是异辛烷,其结构简式如图下列各式可以肯定与上述异辛烷互称为同系物的是( )
作为汽车动力燃料的汽油,其主要成份是异辛烷,其结构简式如图下列各式可以肯定与上述异辛烷互称为同系物的是( )| A. | C2H4 | B. | C8H18 | C. | C7H16 | D. | C6H12 |
①H2SO4溶液
②盐酸
③NaCl溶液
④NaOH溶液
⑤Ba(OH)2溶液.
| A. | ⑤>④>③>②>① | B. | ①>②>③>④>⑤ | C. | ④=⑤>③>①=② | D. | ①=②>③>④=⑤ |
| A. | 浓硫酸的脱水性属物理性质,相应的变化过程是物理变化 | |
| B. | 蓝色石蕊试纸遇浓硫酸先变红后变黑 | |
| C. | 浓硫酸可吸收SO3 | |
| D. | CuSO4•5H2O晶体投入到浓硫酸中,固体颜色由蓝变白 |
| A. | m-n | B. | m+n | C. | m-n-1 | D. | m-n+1 |
 .
.