题目内容
2.下面三种方法都可以制得Cl2:①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑
②2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑
③O2+4HCl(g)$\frac{\underline{\;催化剂\;}}{500℃}$2H2O+2Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )
| A. | O2>MnO2>KMnO4 | B. | KMnO4>MnO2>O2 | C. | MnO2>KMnO4>O2 | D. | O2>KMnO4>MnO2 |
分析 根据反应条件判断反应的难易程度,反应条件越少的氧化还原反应越容易发生,越容易发生的氧化还原反应氧化剂的氧化性越强,据此分析解答.
解答 解:根据方程式①4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O、②2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O、③4HCl(g)+O2$\frac{\underline{\;催化剂\;}}{500℃}$2Cl2+2H2O,②没有反应条件,①的反应条件是加热,③的反应条件是加热和催化剂,反应条件越少的氧化还原反应越容易发生,越容易发生的氧化还原反应氧化剂的氧化性越强,所以氧化性最强的是高锰酸钾,其次是二氧化锰,最后是氧气,故选:B.
点评 本题考查了氧化剂氧化性强弱的判断,根据“反应条件越少的氧化还原反应越容易发生,越容易发生的氧化还原反应氧化剂的氧化性越强”来解答即可,难度不大.

练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
13.如表是三种物质的溶解度(20℃),下列说法正确的是( )
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.00084 | 0.01 |
| A. | 已知MgCO3的K=6.82×10-6moL-2•L-2则所含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6moL2-•L-2 | |
| B. | 将表中三种物质与水混合,加热、灼烧,最终的固体产物相同 | |
| C. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3 | |
| D. | 用石灰水处理含有Mg2+和HCO3的硬水,发生的离子反应的方程式为Mg2++2HCO3+Ca2+2OH═CaCO3↓+MgCO3↓+2H2O |
17.在实验室中,对下列事故或药品的处理正确的是( )
| A. | 做完白磷燃烧实验后,剩余的白磷放入废物缸 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 | |
| D. | 做完钠与水反应的实验后,余下的钠放回原瓶 |
7.下列关于浓硫酸的性质的说法中,错误的是( )
| A. | 浓硫酸的脱水性属物理性质,相应的变化过程是物理变化 | |
| B. | 蓝色石蕊试纸遇浓硫酸先变红后变黑 | |
| C. | 浓硫酸可吸收SO3 | |
| D. | CuSO4•5H2O晶体投入到浓硫酸中,固体颜色由蓝变白 |
14.分离NaCl和NH4Cl的最佳方法是( )
| A. | 利用溶解度不同,采用结晶法 | B. | 加入AgNO3溶液 | ||
| C. | 直接加热法 | D. | 加入烧碱 |
11.两个容积相同的容器,一个盛有NO,另一个盛有N2和O2,在标准状况下,两容器内的气体不一定相同的是( )
| A. | 原子总数 | B. | 物质的量 | C. | 分子总数 | D. | 质量 |
12.下列物质中含有氯分子的是( )
| A. | 氯水 | B. | 漂白粉 | C. | 盐酸 | D. | 氯化镁 |
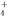 、Al3+、AlO
、Al3+、AlO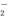 、SO
、SO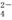 、SiO
、SiO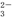 、CO
、CO 的离子是,肯定不存在的离子是。
的离子是,肯定不存在的离子是。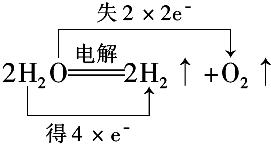 .
.