题目内容
11. 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为11.9mol•L-1.
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是BD.
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol•L-1的稀盐酸.该学生需要量取16.8mL上述浓盐酸进行配制.
分析 (1)根据c=$\frac{1000ρw}{M}$计算;
(2)溶液是均匀的,溶液的密度、浓度不随体积变化;
(3)根据稀释定律,稀释前后HCl的物质的量不变,据此计算需要浓盐酸的体积.
解答 解:(1)质量分数36.5%、密度1.19g/mL 浓盐酸的物质的量浓度=$\frac{1000×1.19×36.5%}{36.5}$mol/L=11.9mol/L,
故答案为:11.9;
(2)溶液是均匀的,溶液的密度、浓度不随体积变化,而HCl的物质的量及Cl-的数目与溶液体积有关,
故答案为:BD;
(3)令需要浓盐酸的体积为V mL,根据稀释定律,稀释前后HCl的物质的量不变,则:V×10-3L×11.9mol/L=0.5 L×0.400mol/L,解得V=16.8,
故答案为:16.8.
点评 本题考查物质的量浓度计算、一定物质的量浓度溶液配制等,难度不大,注意基础知识的积累.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
8.下列叙述正确的是( )
| A. | NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心 | |
| B. | CH2Cl2是非极性分子,分子中C原子处在H、Cl原子所组成的四边形的中心 | |
| C. | H2O是极性分子.分子中O原子不处在2个H原子所连成的直线的中央 | |
| D. | CO2中的C=O键是极性键,所以CO2是极性分子 |
2.生活与化学息息相关,下列生活现象中没有利用过滤原理的是( )
| A. | 制豆腐要用纱布 | B. | 茶具 | ||
| C. | 城市马路边的地漏 | D. | 高速公路边的铁丝网 |
6.五种短周期元素的某些性质如表所示.下列说法正确的是( )
| 元素代号 | X | Y | Z | W | Q |
| 原子半径(nm) | 0.073 | 0.077 | 0.099 | 0.102 | 0.118 |
| 主要化合价 | -2 | +4、-4 | -1 | +6、-2 | +3 |
| A. | 单质沸点:W>Q>Z | |
| B. | W与Q形成的常见化合物可以稳定存在于水溶液中 | |
| C. | Z的含氧酸的酸性大于W的含氧酸的酸性 | |
| D. | X、Y、W三种元素两两之间均能以共价键形成AB2型的化合物 |
 2015年11月首架C919打飞机总装下线,标志着我国跻身飞机研制先进国家行列.
2015年11月首架C919打飞机总装下线,标志着我国跻身飞机研制先进国家行列.
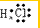 ;由两种元素组成的共价化合物的水溶液显碱性,这种化合物的结构式是
;由两种元素组成的共价化合物的水溶液显碱性,这种化合物的结构式是 .
. →
→ .
.