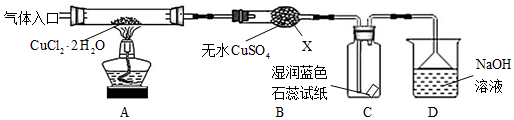
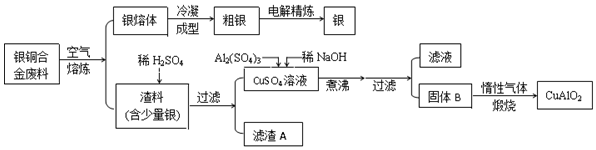
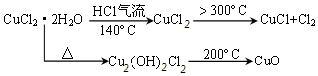题目内容
3.饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,请配平化学方程式:10Al+6NaNO3+4NaOH+18H2O═10NaAlO2+3N2↑+2H2O.若反应过程中转移5mol电子,则生成标况下的N2体积为11.2L.分析 反应中N元素化合价降低,被还原,Al元素化合价应升高,被氧化,溶液呈碱性,则应生成NaAlO2,结合化合价的变化计算.
解答 解:反应中N元素化合价由+5价降低为0价,被还原,Al元素化合价由0价升高为+3价,被氧化,溶液呈碱性,则应生成NaAlO2,反应的化学方程式为10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O,若生成3mol氮气,则转移30mol电子,反应过程中转移5mol电子,则生成0.5mol氮气,体积为0.5mol×22.4L/mol=11.2L,
故答案为:NaAlO2;11.2.
点评 本题考查氧化还原反应,为高考常见题型,侧重考查学生的分析、计算能力,把握反应中元素的化合价变化为解答的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列各组物质按单质、化合物、混合物顺序排列的是( )
| A. | 白磷、熟石灰、生石灰 | B. | 氮气、空气、胆矾 | ||
| C. | 铁、氯化氢、干冰 | D. | 液态氧、烧碱、碘酒 |
14.一块表面已被氧化为Na2O的钠块7.7g,将其投入100g水中,产生H2的质量为0.2g,则被氧化的钠是( )
| A. | 9.2 g | B. | 10.6 g | C. | 6.2 g | D. | 2.3 g |
18.物质的量均为1mol的下述物质①氧化钠②过氧化钠③氢氧化钠④亚硫酸钠,长期放置于空气中(最终物质不考虑潮解情况),最后质量增加的大小关系是( )
| A. | ①=③>②>④ | B. | ①>②>④>③ | C. | ③>①=②>④ | D. | ④>③>②>① |
8.现有200mLc(H+)=0.1mol/L的MgCl2、AlCl3和HCl的混合溶液,其中c(Mg2+)=0.2mol•L-1,c(Cl-)=1.4mol•L-1,欲将该混合溶液中的Mg2+沉淀分离出去,则至少需要加入4mol•L-1的NaOH溶液( )
| A. | 80mL | B. | 72mL | C. | 85mL | D. | 128mL |
12.设NA为阿伏加徳罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LC2H5OH含有的氢原子数为3NA | |
| B. | 高温下,16.8gFe与足量水蒸气完全反应失去的电子数为0.8 NA | |
| C. | 0.1mol/L CH3COONa溶液中CH3COO-和CH3COOH的总数为0.1 NA | |
| D. | 密闭容器中,46gNO2和N2O4的混合气体所含分子数为NA |
13.FeC13、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
| A. | 溶液中一定不含Fe3+ | B. | 溶液中一定含Fe2+ | ||
| C. | 溶液中一定不含Cu2+ | D. | 剩余固体中一定含Cu |
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: