题目内容
4. 硝基苯是一种重要的化工原料,其制备原理是:
硝基苯是一种重要的化工原料,其制备原理是: +HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$
+HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$ +H2O△H<0
+H2O△H<0在温度稍高的情况下会生成副产物间二硝基苯:
 +HO-NO2$→_{△}^{H_{2}SO_{4}}$
+HO-NO2$→_{△}^{H_{2}SO_{4}}$ +H2O
+H2O请将下列制备硝基苯的实验内容填写完整:
(1)混酸的配制:取100mL烧杯,用浓硫酸20mL、浓硝酸18mL配制混酸,其操作过程为在100mL的烧杯中先加入18mL浓硝酸,然后缓慢加入20mL浓硫酸,不断搅拌,冷却到50~60℃.
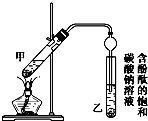
(2)安装反应装置:按图所示安装实验装置,在这个实验中冷凝管的作用是冷凝回流,防止苯和硝酸挥发.
(3)反应步骤:①把18mL的苯加入到三颈瓶中,将混酸加入到分液漏斗中,逐滴滴加混酸,边滴加边搅拌,这样做的目的是防止反应进行得过快,使温度升高得过快,增加反应的副产物.
②混酸滴加完毕后,在加热搅拌的条件下反应半小时.控制加热温度的方法是水浴加热.
③分离和提纯:除去产物中没有反应的酸,可在产物中加入碱溶液,然后用分液漏斗分液,下层物质为粗产品.除去硝基苯中没有反应的苯和生成的副产物的简便方法是(填方法名称)蒸馏.
分析 (1)根据浓硫酸溶于水放出大量的热,且浓硫酸的密度大于硝酸,从实验安全的角度答题;
(2)备硝基苯的反应为放热反应,反应物硝酸、苯都是易挥发的物质,为了提高反应物的转化率,对反应物要冷凝回流;
(3)①备硝基苯的反应为放热反应,反应过快反应温度升高快,会发生副反应生成副产物间二硝基苯,所以要通过控制滴加反应物的量来控制反应速率;
②反应要控制在50~60℃,可以通过水浴加热的方法;
③硝基苯的密度大于水,据此判断粗产品的位置,苯和硝基苯及间二硝基苯互溶但它们的沸点不同,据此可以确定除去硝基苯中没有反应的苯和生成的副产物的简便方法.
解答 解:(1)根据浓硫酸溶于水放出大量的热,且浓硫酸的密度大于硝酸,从实验安全的角度可知,混酸的配制操作过程为在100 mL 的烧杯中先加入18 mL 浓硝酸,然后缓慢加入20 mL 浓硫酸,不断搅拌,冷却到50~60℃,
故答案为:在100 mL 的烧杯中先加入18 mL 浓硝酸,然后缓慢加入20 mL 浓硫酸,不断搅拌,冷却到50~60℃;
(2)备硝基苯的反应为放热反应,反应物硝酸、苯都是易挥发的物质,为了提高反应物的转化率,对反应物要冷凝回流,所以实验中冷凝管的作用是冷凝回流,防止苯和硝酸挥发,
故答案为:冷凝回流,防止苯和硝酸挥发;
(3)①备硝基苯的反应为放热反应,反应过快反应温度升高快,会发生副反应生成副产物间二硝基苯,所以要通过控制滴加反应物的量来控制反应速率,故逐滴滴加混酸,边滴加边搅拌,这样做的目的是防止反应进行得过快,使温度升高得过快,增加反应的副产物,
故答案为:防止反应进行得过快,使温度升高得过快,增加反应的副产物;
②反应要控制在50~60℃,可以通过水浴加热的方法,
故答案为:水浴加热;
③硝基苯的密度大于水,所以粗产品在下层,苯和硝基苯及间二硝基苯互溶但它们的沸点不同,所以除去硝基苯中没有反应的苯和生成的副产物的简便方法是蒸馏,
故答案为:下;蒸馏.
点评 本题主要考查硝基苯的制备、提纯,难度中等,答题时注意有机物性质与实验基本操作的灵活应用.

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10mol SO3和0.010mol O2,到达平衡时,n(SO2)=0.012mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.0070mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050mol SO2和0.030mol O2,达到平衡时SO2转化率大于88% |
 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
①配制2mL浓硫酸、3mL乙醇(含18O)和2mL乙酸的混合溶液.
②按如图所示连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3~5min.
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置分层.
④分离出乙酸乙酯,洗涤、干燥.
(1)配制①中混合溶液的方法为应先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,最后加入冰醋酸;
反应中浓硫酸的作用是催化剂 吸水剂;写出制取乙酸乙酯的化学方程式:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O.
(2)上述实验中饱和碳酸钠溶液的作用是BC(填字母).
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇 C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是减少乙酸乙醇的挥发,减少副反应的发生;步骤③所观察到的现象是试管乙中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;
欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有分液漏斗;分离时,乙酸乙酯应从仪器上口倒(填“下口放”或“上口倒”)出.
(4)该同学反复实验,得出乙醇与乙酸的用量和得到的乙酸乙酯生成量如表:
| 实验 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| ① | 2 | 2 | 1.33 |
| ② | 3 | 2 | 1.57 |
| ③ | 4 | 2 | x |
| ④ | 5 | 2 | 1.76 |
| ⑤ | 2 | 3 | 1.55 |
 用甲烷和二氧化碳可以制备化工原料.
用甲烷和二氧化碳可以制备化工原料.(1)一定温度下,向容积恒为2L的密闭容器中通入3mol CO2,3mol CH4,发生如下反应:
CO2(g)+CH4(g)?2CO(g)+2H2(g)
反应在2min末达到平衡状态,此时测得CO2和CO的体积分数相等.清回答下列问题:
①2min内,用H2来表示的反应速率v(H2)=0.5mol/(L•min);
②此温度下该反应的平衡常数K=1;
③下列叙述可以作为该反应达到平衡状态的标志的是BC;(填选项字母)
A.v正(CH4)=v逆(H2)
B.容器内压强保持恒定不变
C.反应中断裂2mol C-H键同时消耗1mol H2
D.容器内混合气体的密度保持恒定不变
④已知:
| 物质 | H2 | CO | CH4 | CH3COOH |
| 燃烧热(kJ/mol) | 286 | 283 | 890 | 874 |
⑤为提高CH4的转化率,可以采取的措施是减小反应压强、增大CO2的浓度.(写两点)
(2)在催化作用下,甲烷和二氧化碳还可以直接转化成乙酸.
①在不同温度下乙酸的生成速率如图所示:
在250-400℃范围内,乙酸的生成速率随温度变化的原因是温度超过250℃时,催化剂的催化效率降低.
②250℃与400℃时乙酸的生成速率相近,清分析判断实际生产选择的最佳温度是250℃.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质. |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一. |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物. |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出B的氢化物的结构式H-O-H
(2)①写出E单质与A、B、C形成的化合物反应的化学方程式:Cl2+2NaOH═NaCl+NaClO+H2O
②D的氧化物与A、B、C形成的化合物的水溶液反应的离子方程式:Al2O3+2 OH-═AlO2-+H2O.
| A. | Mg2+、H+、Cl-、OH- | B. | Na+、Ba2+、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$ | ||
| C. | Na+、H+、Cu2+、SO${\;}_{4}^{2-}$ | D. | K+、Zn2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ |

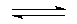 B(OH)4-+H+;
B(OH)4-+H+;