题目内容
某溶液中含有0.2mol/L NH4+、0.25mol/L Fe2+、0.4mol/L Cl-及一定量的SO42-,则SO42-物质的量浓度为( )
| A、0.1mol/L |
| B、0.3mol/L |
| C、0.5mol/L |
| D、0.15mol/L |
考点:物质的量浓度的相关计算
专题:计算题
分析:溶液呈电中性,故溶液中c(NH4+)+2c( Fe2+)=c(Cl-)+2c(SO42-),据此计算.
解答:
解:溶液呈电中性,故溶液中c(NH4+)+2c( Fe2+)=c(Cl-)+2c(SO42-),
即:0.2mol/L+2×0.25mol/L=0.4mol/L+2c(SO42-),
解得c(SO42-)=0.15mol/L,
故选D.
即:0.2mol/L+2×0.25mol/L=0.4mol/L+2c(SO42-),
解得c(SO42-)=0.15mol/L,
故选D.
点评:本题考查物质的量浓度计算,难度不大,注意电解质混合溶液中离子浓度计算常用电荷守恒解答.

练习册系列答案
相关题目
常温下,C(OH-)最小的是( )
| A、pH=0的溶液 |
| B、0.05mol/LH2SO4 |
| C、0.5mol/LHCl |
| D、0.05mol/L的Ba(OH)2 |
下列化学用语正确的是( )
| A、碳一12 的原子符号:612C |
B、羟基的电子式: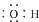 |
| C、氯仿的化学式:CCl4 |
D、甲醇的结构式: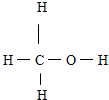 |
下列各对物质间的反应既属于氧化还原反应,又属于离子反应的是( )
| A、Zn+H2SO4(稀) |
| B、NaCl+AgNO3(溶液) |
| C、H2+O2 |
| D、Na2O+H2O |
下列关于有机物的说法错误的是( )
| A、聚乙烯可发生加成反应 |
| B、烯烃分子中所有的原子不一定都在同一平面上 |
| C、食醋中含有乙酸,乙酸可由乙醇氧化得到 |
| D、CCl4可由CH4制得,可萃取碘水中的碘 |
下列有关金属的描述,正确的是( )
| A、Cu和S在加热的条件下反应可生成CuS |
| B、金属铁和铝都可以被浓硫酸钝化,因此铁和铝都不能与浓硫酸反应 |
| C、等质量的金属铝,分别和足量的稀硫酸和氢氧化钠溶液反应,所得氢气一样多 |
| D、除去镀在铝表面的铜镀层,最佳试剂是稀硝酸 |
有一种气体的质量是14.2g,物质的量是0.2mol,该气体的摩尔质量是( )
| A、28.4 |
| B、28.4g?mol-1 |
| C、71 |
| D、71g?mol-1 |
某溶液溶质的质量分数为w%,物质的量浓度为 c mol/L,密度为d g/cm3,此溶液中溶质的摩尔质量(g/mol )为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
 2012年10月浙江省甲醇汽油试点评估完成,为浙江省甲醇汽油的进一步推广应用做好准备,与93号汽油相比,甲醇汽油每升约便宜0.5元-0.6元.已知常温常压下,1mol甲醇(CH3OH)(熔点-97.8℃、沸点64.5℃)在空气中完全燃烧生成液态水时,放出QkJ的热量.请回答下列相关问题:
2012年10月浙江省甲醇汽油试点评估完成,为浙江省甲醇汽油的进一步推广应用做好准备,与93号汽油相比,甲醇汽油每升约便宜0.5元-0.6元.已知常温常压下,1mol甲醇(CH3OH)(熔点-97.8℃、沸点64.5℃)在空气中完全燃烧生成液态水时,放出QkJ的热量.请回答下列相关问题: