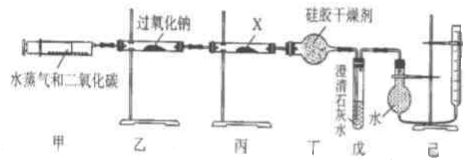
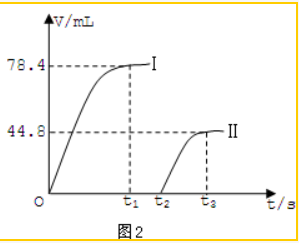
题目内容
17.写出下列物质的电离方程式:Na2SO4Na2SO4=2Na++SO42-
H2SO4H2SO4═2H++SO42-
NH4NO3NH4NO3=NH4++NO3-
Ba(OH)2Ba(OH)2=Ba2++2OH-.
分析 硫酸钠、硫酸、硝酸铵以及氢氧化钡都为强电解质,在溶液中可完全电离,其中硫酸为酸,可电离出氢离子和酸根离子,氢氧化钡为碱,电离出氢氧根离子和金属阳离子,硫酸钠、硝酸铵为盐,电离出酸根离子和阳离子,以此解答该题.
解答 解:Na2SO4为盐,属于强电解质,电离出钠离子和硫酸根离子,电离方程式为Na2SO4=2Na++SO42-,
H2SO4为强酸,电离出氢离子和硫酸根离子,电离方程式为H2SO4═2H++SO42-,
硝酸铵为盐,电离出硝酸根离子和铵根离子,电离方程式为NH4NO3=NH4++NO3-,
氢氧化钡为二元强碱一步完全电离,电离方程式为:Ba(OH)2=Ba2++2OH-,
故答案为:Na2SO4=2Na++SO42-;H2SO4═2H++SO42-;NH4NO3=NH4++NO3-;Ba(OH)2=Ba2++2OH-.
点评 本题考查了电解质电离方程式的书写,明确电解质的强弱是解题关键,注意弱电解质用可逆号,强电解质用等号,注意弱酸的酸式根离子不能拆,题目难度不大.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
19.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 摩尔是七个基本物理量之一 | |
| B. | 阿伏加德罗常数就是6.02×1023mol-1 | |
| C. | 1mol氢的质量是2g | |
| D. | 1个甲烷分子的质量是2.66×10-23g |
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3NA | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 1.8 g D2O中含有的质子数和电子数均为NA | |
| D. | 0.1molNa完全被氧化生成Na2O2时,转移的电子数目为0.1NA |
12.对下列未知盐的稀溶液所含离子的检验中,作出的判断一定正确的是( )
| A. | 加入硝酸银溶液,有白色沉淀生成,可判定含有Cl- | |
| B. | 先加入足量稀盐酸,无沉淀生成,再加BaCl2溶液,产生白色沉淀,可判定含有SO42- | |
| C. | 加入NaOH溶液,有白色沉淀产生,可判定含有Mg2+ | |
| D. | 加入盐酸后有无色、无味气体逸出,此气体能使澄清石灰水变浑浊,可判定含有CO32- |
2.在下列四组物质的水溶液中,仅用一种化学品不能完成组内各种溶液的鉴别的是( )
| A. | Na2CO3、NaCl、AgNO3 | B. | Na2SO4、NaOH、HCl | ||
| C. | Na2SO4、NaNO3、NaOH | D. | Na2SO4、BaCl2、CuSO4 |
9.按官能团的不同可对有机物进行分类,请指出下列有机物的种类错误的一项( )
| A. | CH 3CH 2CH2 CHO醛类 | B. | 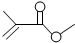 饱和酯类 饱和酯类 | ||
| C. | 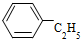 芳香烃 芳香烃 | D. | CH 3CH 2 COOH 羧酸类 |
6.下列所述事实与化学(或离子)方程式不相符的是( )
| A. | 能说明NH3结合H+能力比H2O强:NH3+H3O+=NH4++H2O | |
| B. | 能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| C. | 能说明盐酸是强酸:HCl+AgNO3=AgCl↓+HNO3 | |
| D. | 能说明CH3COOH是弱电解质:CH3COO-+H2O?CH3COOH+OH- |
7.下列说法中,正确的是( )
| A. | H2SO4的摩尔质量是98g | |
| B. | 1molO2的质量是32g | |
| C. | 铁的摩尔质量等于铁原子的相对原子质量 | |
| D. | 1molNa+的质量是23g/mol |