题目内容
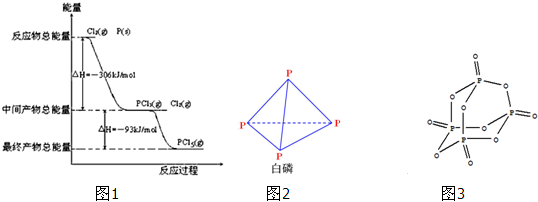
(1)工业上用石英砂和焦炭可制得粗硅.已知:
请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g)△H=
(2)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,请从原子结构与元素的性质角度解释其原因: .
(3)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅.
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,可用 方法提纯SiHCl3.
②用SiHCl3制备高纯硅的反应为 SiHCl3(g)+H2(g)
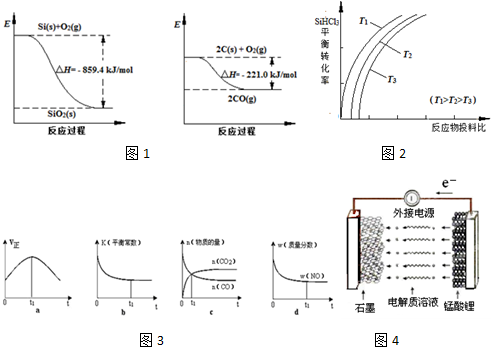
Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图2所示.下列说法正确的是 (填字母序号).
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是
c.实际生产中为提高SiHCl3的利用率,应适当升高温度
(4)安装汽车尾气催化转化器可减轻PM2.5的危害,其反应是:2NO(g)+2CO(g)
2CO2(g)+N2(g)△H<0.
①该反应平衡常数表达式K= ;温度升高K值 (填“增大”或“减小”)
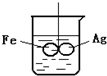
②若该反应在绝热、恒容的密闭体系中进行,图3中示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 .
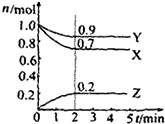
(5)使用锂离子电池为动力汽车如图4,可减少有害气体的排放.锰酸锂离子蓄电池的反应式为:
LixC+Li1-xMnO4
C+LiMnO4
下列有关说法正确的是
a.充电时电池内部Li+向正极移动
b.放电过程中,电能转化为化学能
c.放电时电池的正极反应式为:Li1-xMnO4+xe-+xLi+═LiMnO4
d.充电时电池的正极应与外接电源的负极相连.

请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g)△H=
(2)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,请从原子结构与元素的性质角度解释其原因:
(3)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅.
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,可用
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
| 一定条件 |
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是
| n(SiHCl3) |
| n(H2) |
c.实际生产中为提高SiHCl3的利用率,应适当升高温度
(4)安装汽车尾气催化转化器可减轻PM2.5的危害,其反应是:2NO(g)+2CO(g)
| 催化剂 |
①该反应平衡常数表达式K=
②若该反应在绝热、恒容的密闭体系中进行,图3中示意图正确且能说明反应在进行到t1时刻达到平衡状态的是
(5)使用锂离子电池为动力汽车如图4,可减少有害气体的排放.锰酸锂离子蓄电池的反应式为:
LixC+Li1-xMnO4
| 放电 |
| 充电 |
下列有关说法正确的是
a.充电时电池内部Li+向正极移动
b.放电过程中,电能转化为化学能
c.放电时电池的正极反应式为:Li1-xMnO4+xe-+xLi+═LiMnO4
d.充电时电池的正极应与外接电源的负极相连.
考点:化学平衡的影响因素,原电池和电解池的工作原理,化学平衡的调控作用,硅和二氧化硅
专题:基本概念与基本理论
分析:(1)由图1可得热化学方程式:
①Si(s)+O2(g)═SiO2(s)△H1=-859.4kJ?mol-1
②O2(g)+2C(s)═2CO(g)△H2=-221.0kJ?mol-1
根据盖斯定律可知,热化学方程式SiO2(s)+2C(s)═Si(s)+2CO(g)可由②-①得,△H=△H2-△H1=-859.4-(-221.0)kJ?mol-1=+638.4 kJ?mol-1;
(2)硅烷的分解温度远低于甲烷的原因为:C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”) Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷;
(3)①根据各物质沸点的不同分离提纯物质,可用蒸馏(或分馏)法;
②a.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,则该反应的平衡常数随温度升高而增大;
b.增大一种反应物的浓度,能提高其它反应物的转化率,而本身的转化率反而降低,故横坐标表示的投料比应该是
;
c.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,故实际生产中为提高SiHCl3的利用率,应适当升高温度;
(4)A、到达平衡后正、逆速率相等,不再变化;
B、到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
C、t1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
D、到达平衡后各组分的含量不发生变化;
(5)A.充电时,电池内部阳离子向阴极移动;
B.放电过程中,化学能转化为电能;
C.放电时正极上得电子发生还原反应;
D.充电时电池上标注有“+”的电极应于外接电源的正极相连.
①Si(s)+O2(g)═SiO2(s)△H1=-859.4kJ?mol-1
②O2(g)+2C(s)═2CO(g)△H2=-221.0kJ?mol-1
根据盖斯定律可知,热化学方程式SiO2(s)+2C(s)═Si(s)+2CO(g)可由②-①得,△H=△H2-△H1=-859.4-(-221.0)kJ?mol-1=+638.4 kJ?mol-1;
(2)硅烷的分解温度远低于甲烷的原因为:C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”) Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷;
(3)①根据各物质沸点的不同分离提纯物质,可用蒸馏(或分馏)法;
②a.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,则该反应的平衡常数随温度升高而增大;
b.增大一种反应物的浓度,能提高其它反应物的转化率,而本身的转化率反而降低,故横坐标表示的投料比应该是
| n(H2) |
| n(SiHCl3) |
c.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,故实际生产中为提高SiHCl3的利用率,应适当升高温度;
(4)A、到达平衡后正、逆速率相等,不再变化;
B、到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
C、t1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
D、到达平衡后各组分的含量不发生变化;
(5)A.充电时,电池内部阳离子向阴极移动;
B.放电过程中,化学能转化为电能;
C.放电时正极上得电子发生还原反应;
D.充电时电池上标注有“+”的电极应于外接电源的正极相连.
解答:
解:(1)由图1可得热化学方程式:
①Si(s)+O2(g)═SiO2(s)△H1=-859.4kJ?mol-1
②O2(g)+2C(s)═2CO(g)△H2=-221.0kJ?mol-1
根据盖斯定律可知,热化学方程式SiO2(s)+2C(s)═Si(s)+2CO(g)可由②-①得,△H=△H2-△H1=-859.4-(-221.0)kJ?mol-1=+638.4 kJ?mol-1,
故答案为:+638.4 kJ?mol-1;
(2)C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”) Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷,故硅烷的分解温度远低于甲烷,
故答案为:C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”) Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷;
(3)①根据各物质沸点的不同分离提纯物质,可用蒸馏(或分馏)法,故答案为:蒸馏(或分馏);
②a.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,则该反应的平衡常数随温度升高而增大,故a正确;
b.增大一种反应物的浓度,能提高其它反应物的转化率,而本身的转化率反而降低,故横坐标表示的投料比应该是
,故b错误;
c.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,故实际生产中为提高SiHCl3的利用率,应适当升高温度,故c正确;
故选ac;
(4)2NO(g)+2CO(g)
2CO2(g)+N2(g)△H<0.
①该反应平衡常数表达式K=
;因为正反应放热,故温度升高平衡左移,K值减小,故答案为:
;减小;
②a、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故a错误;
b、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故b正确;
c、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故c错误;
d、NO的质量分数为定值,t1时刻处于平衡状态,故d正确;
故答案为:bd;
(5)a.充电时电池内部Li+向阳极移动,阴离子向阴极移动,故a错误;
b.放电过程中,化学能转化为电能,故b错误;
c.放电时正极上得电子发生还原反应,电极反应式为:Li1-xMnO4+xLi++xe-=LiMnO4,故c正确;
d.充电时电池上标注有“+”的电极应于外接电源的正极相连,形成闭合回路,故d错误;
故答案为:c.
①Si(s)+O2(g)═SiO2(s)△H1=-859.4kJ?mol-1
②O2(g)+2C(s)═2CO(g)△H2=-221.0kJ?mol-1
根据盖斯定律可知,热化学方程式SiO2(s)+2C(s)═Si(s)+2CO(g)可由②-①得,△H=△H2-△H1=-859.4-(-221.0)kJ?mol-1=+638.4 kJ?mol-1,
故答案为:+638.4 kJ?mol-1;
(2)C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”) Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷,故硅烷的分解温度远低于甲烷,
故答案为:C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”) Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷;
(3)①根据各物质沸点的不同分离提纯物质,可用蒸馏(或分馏)法,故答案为:蒸馏(或分馏);
②a.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,则该反应的平衡常数随温度升高而增大,故a正确;
b.增大一种反应物的浓度,能提高其它反应物的转化率,而本身的转化率反而降低,故横坐标表示的投料比应该是
| n(H2) |
| n(SiHCl3) |
c.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,故实际生产中为提高SiHCl3的利用率,应适当升高温度,故c正确;
故选ac;
(4)2NO(g)+2CO(g)
| 催化剂 |
①该反应平衡常数表达式K=
| c2(CO2)c(N2) |
| c2(NO)c2(CO) |
| c2(CO2)c(N2) |
| c2(NO)c2(CO) |
②a、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故a错误;
b、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故b正确;
c、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故c错误;
d、NO的质量分数为定值,t1时刻处于平衡状态,故d正确;
故答案为:bd;
(5)a.充电时电池内部Li+向阳极移动,阴离子向阴极移动,故a错误;
b.放电过程中,化学能转化为电能,故b错误;
c.放电时正极上得电子发生还原反应,电极反应式为:Li1-xMnO4+xLi++xe-=LiMnO4,故c正确;
d.充电时电池上标注有“+”的电极应于外接电源的正极相连,形成闭合回路,故d错误;
故答案为:c.
点评:该题综合考查盖斯定律应用、化学平衡常数和平衡移动、电化学等,题目难度中等,注意相关知识的积累.

练习册系列答案
相关题目
“活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”的说法中不正确的是( )
| A、活化分子之间的碰撞不一定都是有效碰撞 |
| B、升高温度,可使单位体积内活化分子数增多,反应速率加快 |
| C、催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 |
| D、对于有气体参加的反应增大压强,可使单位体积内活化分子百分数增加,反应速率加快 |
 如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )
如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )| A、铁圈和银圈左右摇摆不定 |
| B、保持平衡状态 |
| C、铁圈向下倾斜,银圈向上倾斜 |
| D、银圈向下倾斜,铁圈向上倾斜 |
下列有关离子方程式的书写正确的是( )
| A、氢氧化铜和盐酸的反应:OH-+H+═H2O |
| B、氧化铜和盐酸的反应:Cu2++2H2O═2 H++Cu(OH)2↓ |
| C、铁与硫酸铜溶液的反应:Fe+Cu2+═Cu+Fe2+ |
| D、铁与稀硫酸的反应:Fe+2H+═Fe3++H2↑ |
最近研制出一种新型燃料电池,一个电极通入空气,另一个电极通入汽油蒸气(以丁烷为汽油代表),电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,下列叙述不正确的是( )
| A、固体电解质中O2-向正极移动,向外电路释放电子的电极是负极 |
| B、这个电池负极发生的反应是:C4H10+13O2--26e-═4CO2+5H2O |
| C、这种电池放电时发生的化学反应方程式为:2C4H10+13O2═8CO2+10H2O |
| D、人们追求燃料电池氧化汽油,而不在内燃机里燃烧汽油产生动力的主要原因是燃料电池具有较高的能量利用率 |

 Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下: Ⅰ、某容积不变的密闭容器中充入等物质的量的气体A和B,某温度下发生反应:
Ⅰ、某容积不变的密闭容器中充入等物质的量的气体A和B,某温度下发生反应: