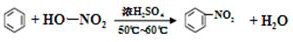题目内容
10.化学与生产、生活密切相关,下列叙述中正确的是( )| A. | 铜制品在潮湿空气中生锈,其主要原因是发生了析氢腐蚀 | |
| B. | 铜的电解精炼工业中,沉积在电解槽底部的阳极泥可作为提炼金、银等贵重金属的原料 | |
| C. | 泡沫灭火器中所装试剂为Na2CO3和Al2(SO4)3 | |
| D. | 从海水中可以制取NaCl,电解饱和NaCl溶液可以制金属Na |
分析 A.铜排在氢的后面,不能与酸反应生成氢气;
B.铜的电解精炼工业中,阳极上金属失电子变成离子进入溶液,比金属铜活泼性差的金、银等固体会沉积下来形成阳极泥;
C.泡沫灭火器中所装试剂为NaHCO3和Al2(SO4)3;
D.电解饱和NaCl溶液的实质是:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
解答 解:A.铜不能置换出氢气,所以铜制品在潮湿空气中生锈,其主要原因是发生吸氧腐蚀,故A错误;
B.铜的电解精炼工业中,阳极上金属失电子变成离子进入溶液,比金属铜活泼性差的金、银等固体会沉积下来形成阳极泥,可作为提炼金、银等贵重金属的原料,故B正确;
C.泡沫灭火器中所装试剂为NaHCO3和Al2(SO4)3,不是Na2CO3和Al2(SO4)3,故C错误;
D.电解饱和NaCl溶液电解过程中阳极上氯离子失电子发生氧化反应,2Cl--2e-=Cl2↑;阴极上是氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑,实质是:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑得不到金属钠,故D错误;
故选B.
点评 本题考查了电解精炼铜原理、铜的腐蚀、泡沫灭火剂、电解等知识,题目难度不大,掌握基础是关键.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
14.设NA为阿伏加德罗常数,下列说法中正确的是( )
| A. | NA个氢气分子所占的体积为22.4L | B. | 2NA个二氧化碳分子的质量为44g | ||
| C. | 32g O2所含的氧原子数目是2NA | D. | 17g氨气中所含原子数为NA |
1. 甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列反应合成甲醇CO(g)+2H2(g)?CH3OH(g)△H
甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列反应合成甲醇CO(g)+2H2(g)?CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K).
由表中数据判断△H<0(填“>”、“=”或“<”),化学平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$;
(2)300℃时,在体积为2.0L的密闭容器中通入2mol CO和4mol H2,经过20s 达到平衡状态,
①计算20s内CO的反应速率为0.025mol/(L•s),此时容器中甲醇的体积分数为25%;
②若向上述平衡体系中同时加入1mol CO,2mol H2和1mol CH3OH气体,平衡移动情况是向右
(填“向右”、“向左”或“不移动”),原因是若向上述平衡体系中同时加入1molCO,2molH2和1molCH3OH气体,此时浓度c(CO)=0.5mol/L+$\frac{1}{2}$mol/L=1mol/L,n(H2)=2(1-0.5)mol/L+$\frac{2mol}{2L}$=2mol/L,c(CH3OH)=0.5mol/L+$\frac{1mol}{2L}$=1mol/L,此时浓度上海Qc=$\frac{1}{1×{2}^{2}}$=0.25<K=1,平衡向右移动;
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1277.0kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5KJ/mol;
(4)甲醇,氧气可制作燃料电池,写出以氢氧化钾为电解质甲醇燃料电池负极反应式CH3OH+8OH--6e-=CO32-+6H2O;如图,电解KI溶液制碘,在粗试管中加入饱和的KI溶液,然后再加入苯,插入一根石墨电极和一根铁电极,使用该燃料电池做电源,铁电极与负极(填正或负)相连接,通电一段时间后,断开电源,振荡试管,上层溶液为紫红色,当有1.27g 碘单质生成时,需要0.053g CH3OH.
 甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列反应合成甲醇CO(g)+2H2(g)?CH3OH(g)△H
甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列反应合成甲醇CO(g)+2H2(g)?CH3OH(g)△H(1)下表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 3.041 | 1.000 | 0.120 |
(2)300℃时,在体积为2.0L的密闭容器中通入2mol CO和4mol H2,经过20s 达到平衡状态,
①计算20s内CO的反应速率为0.025mol/(L•s),此时容器中甲醇的体积分数为25%;
②若向上述平衡体系中同时加入1mol CO,2mol H2和1mol CH3OH气体,平衡移动情况是向右
(填“向右”、“向左”或“不移动”),原因是若向上述平衡体系中同时加入1molCO,2molH2和1molCH3OH气体,此时浓度c(CO)=0.5mol/L+$\frac{1}{2}$mol/L=1mol/L,n(H2)=2(1-0.5)mol/L+$\frac{2mol}{2L}$=2mol/L,c(CH3OH)=0.5mol/L+$\frac{1mol}{2L}$=1mol/L,此时浓度上海Qc=$\frac{1}{1×{2}^{2}}$=0.25<K=1,平衡向右移动;
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1277.0kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5KJ/mol;
(4)甲醇,氧气可制作燃料电池,写出以氢氧化钾为电解质甲醇燃料电池负极反应式CH3OH+8OH--6e-=CO32-+6H2O;如图,电解KI溶液制碘,在粗试管中加入饱和的KI溶液,然后再加入苯,插入一根石墨电极和一根铁电极,使用该燃料电池做电源,铁电极与负极(填正或负)相连接,通电一段时间后,断开电源,振荡试管,上层溶液为紫红色,当有1.27g 碘单质生成时,需要0.053g CH3OH.
18.下列关于胶体的叙述正确的是( )
| A. | 利用丁达尔效应可以区分淀粉溶胶和肥皂水 | |
| B. | 1L1 mol•L-1Fe(OH)3胶体中,胶粒数目小于NA | |
| C. | PM2.5是指大气中直径接近于2.5×10-6m(1m=109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 | |
| D. | Fe(OH)3胶体的电泳实验说明了胶体带有电荷 |
2.下列说法正确的是( )
| A. | 所有反应的反应热都可以由实验直接测定 | |
| B. | 任何化学反应都需要用活化能来引发 | |
| C. | 200°C、101KPa时,1g氢气与碘蒸气作用生成HI气体,放出7.45kJ热量,则此过程的热化学方程式可表示为:H2(g)+I2(g)=2HI(g)△H=-14.9kJ/mol | |
| D. | 没有物质的变化,就不能引发能量的变化 |
19.在蒸发皿中加热蒸干并灼烧(<400℃)下列物质的溶液,可以得到该物质的固体的是( )
| A. | AlCl3 | B. | MgSO4 | C. | Na2SO3 | D. | Ca(HCO3)2 |


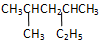 的系统命名是:2,4-二甲基己烷
的系统命名是:2,4-二甲基己烷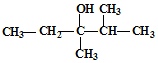 的键线式是
的键线式是
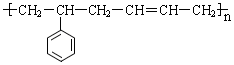 的单体结构简式为:
的单体结构简式为: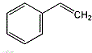 和CH2=CH-CH=CH2
和CH2=CH-CH=CH2